Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















7.3.2.7 Koordinasyon Kovalens Bağ
İyonik bağlar elektron alışverişi ile, kovalens bağlar iki atomun karşılıklı elektron katkıları ile meydana gelen bağ türleridir. Koordinasyon kovalens bağlarda ise bağı teşkil eden elektronlar (genelde elektron çifti) bir atom veya atom grubu tarafından temin edilir. Bağ için elektron veren atom veya moleküllere elektron donör ya da kısaca Ligand diğer bileşene de elektron ekseptör ya da Merkez Atom denilir. Örneğin, Ag-
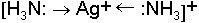

NH3 molekülü ligand Ag+ iyonu ise merkez atom fonksiyonu göstermiştir. Amonyak molekülündeki bağ yapmamış serbest elektron çifti Ag atomunun orbitallerinde bulunan koordinasyon boşluklarına yönlenir.Merkez bir atom ile bunun çevresinde yer alan ve ligand denilen yüklü ya da nötral atom veya atom gruplarından oluşmuş bileşiklere koordinasyon bileşiği veya metal kompleksi denir.
Bir merkezi atomun dolayındaki ligand sayısına o merkezi atomun koordinasyon sayısı denir [Cu(NH3)]2+ örneğinde Cu2+ iyonunun koordinasyon sayısı 4'tür.Merkez iyon ile buna bağlı ligandların arasında kovalensin varlığı birçok kompleks bileşiğin yapısını açıklamağa yarar. Bu bağların sonucu merkezi iyon asal gaz elektron düzenini alır. Böylece; [Co(NH3)6 ]3+ kompleks iyonunda Co3+ iyonu 27 -
(1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 ).
Ancak koordinasyon bileşiklerinde de her zaman okted mümkün olmaz. Örneğin demir elementinin siyanür anyonu ile verdiği iki kompleks iyondan sadece birinde okted gerçekleşir. Bu iki kompleks yapının elektronik düzenleri;
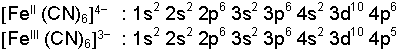
şeklindedir. Her iki kimyasal yapı da kararlıdır ve elde edilebilir, ancak oktedin sağlandığı [FeII (CN)6]4-
İki koordinasyon bileşiği. Üstteki [Co(NH3)6]Cl3, alttaki bileşik ise [CoCl(NH3)5]Cl2
7.3.3 Metalik Bağlar
Metalik bağ; likid (sıvı) ve solid (katı) halde mevcut olabilir. Yukarıda konu edilen iyonik ve kovalens bağ kuvvetleri bir molekülün iki atomu arasında kendini gösterirse de metalik bağ çok sayıda atom, hatta kütleyi oluşturan bütün atomlar arasında söz konusudur.
Metalik bağlar her ne kadar kimyasal bir değişme sonucu ortaya çıkmamış olmasalar da oluşum makenizmalarının iyonik bağa olan yakın benzerliği nedeniyle kimyasal bağ olarak kabul edilirler. Gaz fazında ve düşük basınçta Na atomlarından ibaret bir sistem düşünelim. Her Na atomunun en dış tabakasında kolayca verebileceği bir elektronu vardır; fakat Na+Cl-
Metalik bağ, metallerin valens elektronlarının katı kütle içinde serbest dolaşımı ile meydana gelir. Valens elektronları tek bir atoma değil kütle içindeki bütün atomlara eşit oranda aittir. Bu bakımdan bir metal kütlesi; valens elektronlarının oluşturduğu hareketli negatif yük ortamında (elektron bulutunda) yer alan pozitif yüklü metal atomları şeklinde tarif edilebilir.
7.3.4 İyonik ve Kovalens Bağ Karakteri
İyonik bağların polarizasyon sebebiyle ideal halden sapmaları gibi kovalens bağlarda da rezonans nedeniyle ideal kovalens halden sapmalar görülür. Başka bir ifade ile saf iyonik bağ olmadığı gibi %100 saf kovalens bağ da mümkün değildir. Ancak bir bağda hakim karakterden söz edilebilir.
Genel olarak; periyodik sistemde uzak gruplar arasında iyonik kimyasal bağlar söz konusudur. Örneğin 1A ve 2A elementleri ile 6 ve 7A elementleri arasında iyonik bağlı bileşikler vardır. Periyodik cetvelde, elementin bulunduğu gruplar arasındaki mesafe azaldıkça bağın iyonik karakteri de azalır. 4 ve 5A grubundaki elementlerin 6 ve 7A elementleriyle yaptığı bileşiklerde; kimyasal bağ büyük oranda kovalens karekter içerir.
7.4 Fiziksel Bağlar
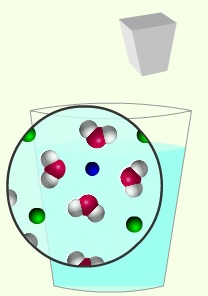
İyon, atom ve moleküller arasındaki zayıf etkileşmeler, kimyasal bağlarda olduğu gibi yeni maddelerin oluşmasına neden olmaz, ancak; erime ve kaynama noktası, buharlaşma ısısı, çözünürlük, yoğunluk, vizkozite, termik dayanıklılık gibi fiziksel ya da fizikokimyasal özelliklerini etkiler. Örneğin; izoelektronik yapıdaki (aynı elektron düzenine sahip) H2O ve H2S yapı birimlerinden; H2O moleküllerinin kendi aralarındaki fiziksel etkileşim (çekme) kuvvetleri daha büyük olduğu için normal şartlar altında su sıvı, hidrojensülfür gazdır.
Fiziksel etkileşimlerden doğan kuvvetler, Van der Waals kuvvetleri ve Hidrojen Köprüleri olmak üzere iki grupta toplanır. Her iki grup içinde temel kuvvet elektrostatik Coulumb Kuvveti olup sadece oluşum mekanizmalarında farklılıklar vardır.
7.4.3 Van Der Waals Kuvvetleri
Van der Waals kuvvetleri aynı türden etkileşimler sonucunda oluşan kuvvetler değildir. Moleküllerin polar ve apolar olmasına göre ikiye ayrılır.
Moleküllerin polar olması halinde bu kuvvet dipol-
- İyon-
dipol kuvvetleri, - Dipol-
dipol kuvvetleri ve - İndüklenmiş dipol kuvvetleri
olarak üç bölümde incelenmelidir. Maddelerin özelliklerini etkileyen bu fiziksel etkileşim kuvvetlerini hem büyüklük hem de etkinliklerinin geçerli olduğu uzaklıklar yönünden incelemek gerekir.
7.4.3.1 İyon-
İyonik kristal şebekesine sahip katılar ile dipol karekteri taşıyan bileşikler arasında iyon-
Pozitif yüklü bir Z+ iyonuna, polar bir molekül negatif ucu ile yaklaşmış olsun. Polar molekülün kısmi (-
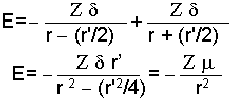
bağıntısı ile gösterilebilir. Bağıntıda r >> r' olduğu varsayılmış ve r yanında r' ihmal edilmiştir. İyon bağının enerjisi uzaklıkla birinci dereceden ters orantılı olduğu halde, iyon-
Suda çözünen NaCl
7.4.3.2 Dipol-
Bu etkileşime polar moleküllerden oluşan sıvıların birbiri içinde çözünmesi örnek olarak verilebilir. Etil alkol ve su birbiri içinde çözünerek her oranda homojen karışımlar meydana getirebilirler. Bu maddelerde moleküllerin her ikisi de polardır. Ayrıca suyun kolaylıkla sıvı hale getirilebilmesi, molekülleri arasındaki dipol-

Dipoller çeşitli şekillerde yönlenebilir. İki dipolün paralel olarak yönlendikleri ve farklı yüklerin birbirine yakın duracağı göz önüne alınırsa, iki dipol arasındaki elektrostatik etkileşimden ileri gelen potansiyel enerji;
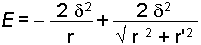
bağıntısı ile gösterilir. Bu bağıntı;
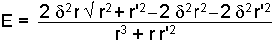
şeklinde de yazılabilir ve r >> r' r, r' den çok uzak ise
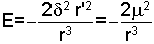
şeklini alır.
Dipol-
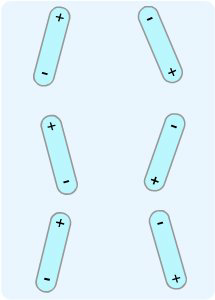
Dipol-