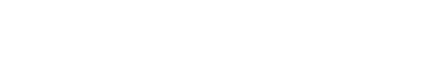Herhangi iki A ve B atomlarının meydana getirdiği moleküldeki bağın yüzde iyonik karakteri ; Y = 18 (EA - EB)1,4 denklemi ile yaklaşık olarak hesaplanabilir. EA, EB A ve B atomlarının elektronegativiteleri olup E = Ei- Ea / 5,6 eşitliği ile bulunur. Ea = elektron ilgisi, Ei = iyonizasyon potansiyelidir.
Örnek : B atomunun iyonizasyon potansiyeli EiB = 13.6, elektron ilgisi EaB = - 0,7'dir. A atomunun iyonizasyon potansiyeli EiA = 13 ve elektron ilgisi EaA = -3.6'dır. A- B bağının iyonik bağ oranı, önce elektronegativite değerleri hesaplanarak bulunabilir:
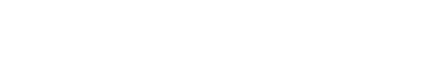
O halde A - B bağı için kovalens diyebiliriz. Çünkü yaklaşık % 95 kovalens karakter hakimdir. Örnekten de anlaşılacağı gibi bağ yapan atomların elektronegativiteleri bağın cinsini tayin etmekte, ancak % 100 iyonik ya da % 100 kovalent bağ mümkün olmamaktadır.