Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















7.4.3.3 İndüklenmiş Dipol Kuvvetleri
Moleküller arası kuvvetlerin bazı türleri etki ile elektriklenmeye dayanır. Yüklü bir atom çevresinde elektrik alanı oluşturur. Yüksüz atom ve moleküller de bu alandan etkilenirler. Örneğin pozitif yüklü bir iyonun yakınında yüksüz bir molekül varsa moleküldeki atomlarda bulunan elektronlar (+) yük tarafından çekileceğinden (+) yüke yakın bölgesinde elektron yoğunluğu artar. Elektronlar molekülün (+) yüke uzak olan bölgesinden geldiğinden uzak olan bölgede de elektron noksanlığına bağlı olarak kısmi (+) yük oluşur. Böylece, başlangıçta apolar olan bir molekülde kısa süre için de olsa, (+) ve (-
İndüklenmiş dipol momentinin büyüklüğü
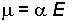
eşitliğine göre elektrik alanı kuvveti E ile doğru orantılıdır. Bağıntıdaki orantı katsayısına polarlaşabilme sabiti denir.
Tahmin edilebileceği gibi elektronları çekirdekler tarafından kuvvetle çekilen moleküllerde elektron göçü güç olacağından, bu moleküllerin polarlaşabilmeleri güçtür ve sabiti küçüktür. Elektronların çekirdekler tarafından kuvvetle tutulması halinde atomun elektronegatifliği de yükselecektir. Bu sebeple elektronegatifliği yüksek flor atomlarının oluşturduğu F2 molekülünün polarlaşabilme eğilimi azdır. Elektronların rölatif zayıf kuvvetle tutulduğu büyük atomlarda, örneğin; I2 molekülünde polarlaşabilme daha kolay olur.
Kimyasal yapı birimleri arasındaki bu etkileşimleri,
- iyon-
indüklenmiş dipol , - dipol-
indüklenmiş dipol ve - indüklenmiş dipol-
indüklenmiş dipol kuvvetleri
olarak üçe ayırmak mümkündür.
Yüklü bir atom çevresinde elektrik alanı oluşturulduğunda yüksüz atom ve moleküller de bu alandan etkilenirler.
7.4.3.3.1 İyon-
İyonların apolar moleküllere etkisi, büyük cisimlerde indüklenme ile oluşan elektrik alanın etkisine benzer. Molekülerde de elektronlar bir dış elektrik alanın etkisinde bir bölgeden başka bir bölgeye göç eder ve dipol oluşur. İyonik bileşiklerin organik bileşiklerle etkileşiminde bu kuvvetler ortaya çıkar.
İndüklenmiş dipoller bir dış etki nedeniyle oluştuklarından daima çekme yönünde etki yaparlar. İndüklenmiş dipolün başka bir yüklü molekülü itmesi düşünülemez. İyonlar ile apolar moleküller arasındaki çekme kuvvetinden oluşan potansiyel enerji;
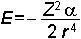
Bağıntısı ile gösterilebilir.
Dipol-
Dipol-
Bu etkileşimler genellikle polar ve apolar maddelerin karışmasında söz konusu olmaktadır. Örneğin; apolar I2 moleküllerinin polar bir solvent olan etanol içinde çözünmesi bir dipol-
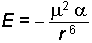
Hesaplama yapıldığında r6 ile ters orantılı olan Dipol-
Bir iyonun apolar molekül üzerindeki etkis
Bir polar molekülün apolar molekül üzerindeki etkisi.
7.4.3.3.2 İndüklenmiş Dipol-
Bu etkileşim apolar moleküller arasında gerçekleşir. Bu tür moleküller arasında da çekim kuvvetlerinin bulunduğu asal gazlar, hidrojen, azot veya metan gibi apolar maddelerin sıvı hale geçebilmesinden kesinlikle anlaşılmaktadır. İyonlar veya polar moleküller arasındaki çekme kuvvetleri elektrostatik etkileşim ile kolaylıkla açıklanabildiği halde, apolar moleküller arasındaki çekme kuvvetlerinin açıklanması için daha başka teorik yaklaşımlara ihtiyaç vardır.
Bu kuvvetler ilk defa Fritz London tarafından kuantum mekaniği prensipleri ışığında izah edilmiştir. İndüklenmiş dipol-
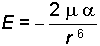
bağıntısı ile gösterilebilir.
London kuvvetlerinin büyüklüğü uzaklığın altıncı kuvveti ile ters orantılı olduğundan, ancak çok kısa uzaklıklarda geçerlidir, ancak maddelerin fiziksel özelliklerini belirleyici olurlar.
7.4.4 Hidrojen Köprüleri
Hidrojen köprüleri (veya hidrojen bağı) bir tür dipol-
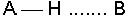
Hidrojen atomu, flor, oksijen ve azot gibi elektronegatif bir atoma bağlandığında polarlaşma nedeniyle kısmi bir pozitif yük kazanır. Diğer atomun ortaklanmamış elektron çiftleri kısmi (+) yüklü hidrojen ile etkileşime girerek hidrojen bağını oluşturur. Hidrojen köprülerinin enerjisi, bağ ile ilgili atomlara veya moleküllere göre değişir, ancak ortalama bir değer olarak 30 kJ mol-
Hidrojen köprülerinin en etkin olduğu atomlar, elektronegatifliği yüksek olan flor, oksijen ve azottur. Ancak bazı hallerde metil grubu protonları da elektronegatif atomlar ile hidrojen bağı oluşturur. Ancak bu bağlar çok zayıftır. Elektronegativite dışında molekül büyüklüğü, atom başına kovalens bağlı hidrojen sayısı gibi yan parametreler de hidrojen köprülerinin kuvvetini etkiler.
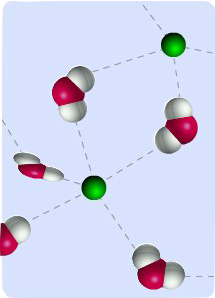
Hidrojen köprüleri.
7.5 Fiziksel Etkileşim Kuvvetlerinin Madde Özelliklerine Etkisi
Moleküllerarası fiziksel etkileşim kuvvetleri maddelerin fiziksel özelliklerini belirleyen en önemli büyüklüklerdir. Maddenin fiziksel halini belirleyen başlıca parametre olan fiziksel etkileşimler özellikle erime, kaynama noktaları, buharlaşma ısısının değeri ve çözünürlük üzerinde kendini gösterir.
Erime ve kaynama noktaları molekül içi kimyasal bağlara değil, atom ve moleküller arasındaki kuvvetlere bağlıdır. Örneğin asal gazlarda atomlararası kuvvetler London kuvvetidir. Maddenin temperatürü yükseltildiğinde moleküllerin kinetik enerjisi artar. Kinetik enerji moleküllerarası kuvveti yenecek seviyeye geldiğinde sıvı kaynar. O halde kaynama noktalarının büyüklüğünden moleküllerarası etkileşim enerjisini tahmin etmek mümkündür. Karbon tetraklorür ve metan apolar moleküllerdir. Bu maddelerin her ikisinde de moleküllerarası kuvvetler London kuvvetleridir. Karbon tetraklorürün kaynama noktası (76.8oC), metanınkinden (-
Bölüm Özeti
Kimyasal bağlar konusu içinde
- İyon, atom ve moleküllerin birbirleri ile, girişimin derecesine bağlı olarak, çeşitli enerji değerlerinde olabilen karşılıklı etkilerini, fiziksel ve kimyasal etkileşimlerini,
- Kimyasal etkileşim kuvvetleriden iyonik, kovalens ve metalik bağları,
- Elektronun doğası gereği kimyasal bağlarda gözlenen rezonansı,
- Atomların etkin çekirdek yükleri büyüklüğüne göre her atom bağ elektronlarını farklı ölçüde çektiğini.
- Etkin çekirdek yükünün aşırı değerleri sonucunda iyonik bağların polarizasyon nedeniyle ideal halden sapmalarını,
- Van der Waals kuvvetleri ve Hidrojen Köprüleri olarak iki ana grupta toplanan fiziksel etkileşim kuvvetlerini,
- Fiziksel etkileşim kuvvetlerinin madde özelliklerine etkisini
inceledik.