Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















8. Maddenin Üç Hali
Bilindiği gibi madde olarak tanımlayabildiğimiz her şey katı sıvı ve gaz fazlardan birini öncelikli olarak tercih eder. Maddenin bu tercihinde etkili olan nedenler ile katı, sıvı ve gaz hallerin genel özellikleri bu konu içinde yer alacaktır. Gaz fazda geçerli yasalar ile madde davranışlarını açıklayan klasik kinetik teori de kapsam içindedir. Maddenin üç hali, fiziksel etkileşim kuvvetleri ve diğer yapısal özellikler dikkate alınarak değerlendirilecektir.
Bölüm Hedefi
Bu bölümü tamamladığınızda,
- Maddenin üç halinin genel tarifini,
- Fiziksel etkileşim kuvvetlerinin büyüklüğü ile katı, sıvı ve gaz fazların belirlenmesini,
- Gaz faza ait genel özellikleri,
- Gaz faz için geçerli yasaları,
- İdeal gaz-
gerçek gaz ayırımını, - Sıvı faza ait genel özellikleri,
- Katı madde tanımları ve katıların genel özelliklerini,
- Katıların sınıflandırılmasını,
- İyonik, kovalens, moleküler ve metalik kristallerin genel özelliklerini
öğrenmiş olacaksınız.
8.1 Maddenin Halleri
Madde kavramı ile tanıdığımız cisimler, yapı birimlerinin özelliklerine ve birimleri arasındaki etkileşimlere bağlı olarak normal şartlar altında (1 atm., 250C) üç aggregat halinde (fazda) bulunabilirler; gaz, sıvı (likid), katı (solid). Bir maddenin hangi fazda bulunacağı, atom ve molekülleri arasındaki fiziksel etkileşim kuvvetleri tarafından tayin edilir. Ancak fiziksel etkileşim kuvvetlerinin büyüklüğü her şart altında eşit değildir, basınç ve sıcaklık ile geniş aralıklarda değişir. O halde maddenin gaz, likid ve solid fazlar arasındaki tercihi sadece yapısal özellikler ile ilgili olmayacaktır. Özetle; maddenin aggregat hali,
- yapısal özellikleri,
- çevre şartları
tarafından belirlenir.
Fiziksel sistemlerde, aynı madde aynı zamanda birden fazla aggregat halinde (katı, sıvı ve gaz halleri ya da fazları) varolabilir. Bunun sebebi, belirli şartlarda, atom ve moleküller arasındaki etkileşim kuvvetlerinin kütleyi meydana getiren bütün birimler arasında eşit değerler alamayacağı gerçeğidir. Planck kuantum hipotezinde bahsedildiği üzere; belirli bir sıcaklıkta katı yüzeyindeki bütün atomlar eşit frekans ile titreşemeyeceği gibi, herhangi bir fazdaki bütün atom ve moleküller de aynı enerji değerinde bulunmazlar. Bu durum; Kuantum Mekaniği prensiplerinin gereğidir ve ayrıca temel fizik yasalarından olan Boltzmann Dağılım Yasası ile de açıklanabilmektedir.
O halde, yapısal özelliklerden kaynaklanan birimlerarası etkileşimlerin büyüklüğü farklı değerler alabilecektir. Böylece, belirli çevre şartlarında; kütleyi meydana getiren kimyasal bakımdan bağımsız yapı birimlerinin bir kısmı arasındaki fiziksel etkileşim kuvvetinin değeri, onlardan sıvı fazı oluşturabilecek büyüklükte, diğer bir kısmının arasındaki etkileşim ise katı fazı oluşturabilecek kadar büyük olabilir. Hatta bu kütle içinde, yapı birimlerinin bir bölümü etkileşim kuvvetini tama yakın ölçüde etkisiz kılacak şekilde, göreceli yüksek kinetik enerjilere sahip olabilir ve gaz fazında bulunabilir. Buna göre; sabit basınç ve sıcaklıkta bir maddenin üç fazda da bulunabilmesi mümkündür. Örneğin; 00C' de suyun üç fazı; katı (buz), sıvı ve gaz (buhar) birlikte bulunmaktadır (00C'de suyun gaz fazındaki oranı pratik bir değer taşımaz ve genelde ihmal edilir, ancak olmadığını söylemek yanlıştır).
Belirli basınç ve sıcaklık şartlarında bir madde için üç fazın birlikte mümkün olması çok rastlanan bir durum değildir. Birçok madde, örneğin; metal ve metal alaşımları, polimer yapılar, cam türünden maddeler, katı fazdadır. Bunları gaz ve sıvı faza geçirmek veya asal gazları sıvılaştırmak aşırı basınç ve sıcaklık şartları gerektirir ya da hiç mümkün olmayabilir. Bu yüzden birçok maddenin, standart şartlarda ve hatta çok geniş basınç ve sıcaklık aralıklarında pratik bakımdan tek fazlı olduğu kabul edilir.
O halde; çevre faktörleri olan basınç ve sıcaklık yapısal özelliklerin izin verdiği ölçüde etkili olmaktadır.Yapısal özellikler arasında; molekül büyüklüğü, polarlık, mevcut kimyasal bağların niteliği, molekülün polarlaşabilirliği, dipol karakteri, kristal şebeke düzeni, hidrojen köprülerinin olması sayılabilir.
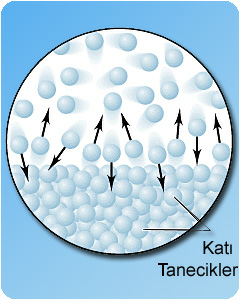
Aynı maddenin katı ve gaz hali.
8.2 Gazlar
Maddenin mikro yapısının aydınlatılması çalışmalarında gazların önemli rol oynaması ve gaz fazın oldukça basit araçlarla incelenebilir olması, öncelikle maddenin gaz halinin özelliklerinin belirlenmesine yol açmıştır.
Gaz fazında maddenin atom ve molekülleri arasındaki etkileşim kuvvetleri çok düşük olduğundan birbirinden bağımsız hareket edebilirler. Bu durum, bütün maddelerin gaz fazında yaklaşık aynı fiziksel özellikleri göstermesine neden olur. Çünkü; fiziksel özellikleri belirleyen, atom ve moleküller arasındaki kuvvetlerin büyüklüğüdür ve gaz fazında bu kuvvetler yok denecek kadar küçük olup, her gaz için hemen hemen eşittir. Yapı birimleri arasında yaklaşık aynı etkileşim kuvvetleri geçerli olacağı için aynı fiziksel özellikler söz konusu olacaktır.
8.2.1 Gazların Genel Özellikleri
Yaklaşık aynı fiziksel özellikleri gösterdikleri için,Bütün maddeler gaz fazında kardeştir. denilir. Bu yüzden her madde için, sadece gaz fazında geçerli olan temel büyükler olmalıdır. Örneğin; basınç, gaz halindeki bütün maddeler için ortak parametredir. Bunun yanında akışkanlık, diffüzyon gibi sıvı fazda da görülen bir takım fiziksel nitelikler de tüm gazlar için genel özelliklerdir.
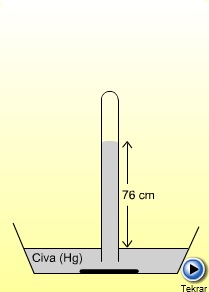
Gazlar içinde bulundukları kabın şeklini alır ve bulundukları kabın iç yüzeylerine bir kuvvet uygularlar. Gaz basıncı olarak tanımlanan bu kuvvete en açık örnek; etrafımızda bulunan havanın yeryüzüne uyguladığı basınçtır. Atmosfer içindeki hava kütlesi dünya yüzeyine belirli bir kuvvet uygular, bu 76 cm yüksekliğindeki civa sütununun yaptığı kuvvete eşittir.
Kuvvet = kütle x ivme olduğuna göre; CGS birim sisteminde, bu kuvvet için,
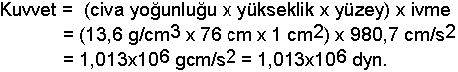
bulunur. Bu, bir atmosfer baskısıdır ve 1 atm = 760 mmHg = 760 tor veya 1,013x106 dyn/cm2 olarak ifade edilir.
Gazların genel davranış biçimi basınç-
8.2.2 Gaz Yasaları
Bu bölüm altında şu alt başlıkları inceleyeceksiniz.
- Boyle Yasası
- Charles ve Gay Lussac Yasası
- İdeal Gaz Denklemi ve Kombine Gaz Yasası
- Dalton Kısmi Basınçlar Yasası ve Graham Diffüzyon Yasası
Henry Yasası
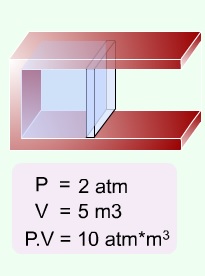
8.2.2.1 Boyle Yasası
1662 yılında Robert Boyle tarafından "bir gazın her sıcaklıkta, basınç ve hacminin çarpımı sabittir" ifadesine uyan denel sonuçlar elde edilmiştir. Yasa matematik eşitlik ile, farklı T1, T2, T3 ve Tn sıcaklıkları için;
şeklinde yazılabilir.
* Animasyondaki barı sağa ve sola hareket ettirerek basıncın ve hacmin nasıl değiştiğini gözlemleyiniz.
 Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri

Bölüm -