Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















8.2.2.2 Charles ve Gay Lussac Yasası
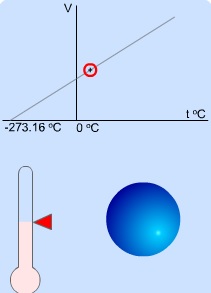
Sabit basınçta bir gazın sıcaklığı ile hacmi arasındaki bağıntı, V= V0(1+ a×t)'dir ve Charles ve Gay-
V hacimi ile t sıcaklığı arasında bir grafik çizilirse doğru, t eksenini -
P=P0(1+at) Sabit hacimde bir gaz ısıtıldığında veya soğutulduğunda, basıncı her sıcaklık derecesi için ilk basıncının 1/273 kadar artar veya azalır. T = t + 273 alınarak; V=V0(1+a×t) denkleminden V/V0 = T/T0 veya genel olarak,
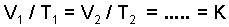
elde edilir.Bundan başka hacim ve basınç bağıntıları a = 1/273 ve t = T-
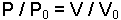
denklemi yazılır. Bu bir gazın basıncı ile hacminin ters orantılı olduğunu gösterir ve PV = sabit eşitliği ile ifade edilen Boyle Yasası'na uyar.
8.2.2.3 İdeal Gaz Denklemi ve Kombine Gaz Yasası
Her iki yasanın birleştirilmesinden İdeal Gaz Denklemi ve Kombine Gaz Yasası türetilir. Boyle Yasası'na göre;
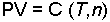
dir. C gazın sıcaklığı T ve mol sayısı n'e bağlı bir sabittir. Charles Yasası'na göre;
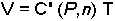
dir ve C' sabiti gazın basınç ve mol sayısına bağlıdır. Sabit basınçta hacim sıcaklık ile doğru orantılı olduğundan,
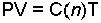
yazılabilir. C mol sayısına bağlı bir sabittir. Bunun yerine n×R çarpımı alınırsa;
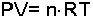
İdeal Gaz Denklemi elde edilir. R sabiti genel gaz sabiti olarak adlandırılır.
(R= 0,008206 litre-
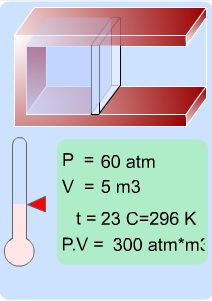
PV = n×RT eşitliğinden bir gazın aynı miktarının değişik P, V ve T değerinde sabit bir çarpım verdiği anlaşılır.
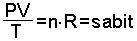
O halde aynı miktar gazın 1. ve 2. hali arasında;
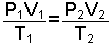
eşitliği vardır. Bu matematik ifade Kombine Gaz Yasası olarak bilinir.
Barın pozisyonunu ve sıcaklığı değiştirerek PV eşitliğinin nasıl değiştiğini gözlemleyiniz.
8.2.2.4 Dalton Kısmi Basınçlar Yasası ve Graham Diffüzyon Yasası
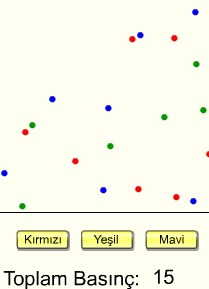
Dalton Kısmi Basınçlar Yasası; "Bir gaz karışımının toplam basıncı, karışımı oluşturan gazların kısmi baskılarının toplamına eşittir" şeklinde ifade edilir ve
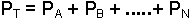
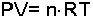
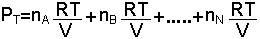
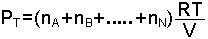
yazılır.
denklemi kullanılarak,
veya
denklemleri ile gösterilir. Eşitliğe göre; karışımı oluşturan gazlardan birinin kısmi basıncı o gazın karışımdaki mol kesri ile toplam basıncın çarpımına eşittir. Örneğin A ve B karışımında A'nın kısmi basıncı;
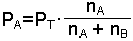
olur.
Graham Diffüzyon Yasası
Bu yasa çeşitli gazların mikro ölçekteki çok küçük çaplı deliklerden geçiş hızının gazın yoğunluğuna ya da mol tartısına bağlı olduğunun gözlenmesinden elde edilmiştir. 1829 yılında Graham tarafından bulunan yasanın ifadesi şöyledir: "Aynı sıcaklık ve basınçta çeşitli gazların difüzyon hızları, bunların yoğunlukları ya da mol tartılarının kare kökü ile ters orantılıdır" Buna bağlı olarak, iki farklı gazın difüzyon zamanları, yoğunlukları ile doğru orantılı olacaktır. Yasa ile ilgili eşitlikler;
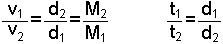
şeklindedir. t ve v difüzyon zamanı ve hızı, M ve d gazların mol tartıları ve yoğunluklarıdır.
8.2.2.5 Henry Yasası
Gazlar çeşitli sıvılarda ve özellikle suda belirli miktarlarda çözünürler. Çözünürlüğe etki eden en önemli faktör gazın sıvı üzerindeki kısmi basıncıdır. Henry Yasası; "bir gazın sıvıdaki çözünürlüğü, o gazın sıvı üzerindeki kısmi basıncı ile doğru orantılıdır" şeklinde açıklanır ve
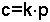
eşitliği ile gösterilir. k çözücüye ve gaza bağlı bir sabittir. Bir gaz karışımının çözünürlüğü söz konusu olursa bu takdirde her gazın çözünürlüğü o gazın kısmi basıncıyla orantılı olacaktır. Henry Yasası, gazın çözücü sıvı ile kimyasal reaksiyona girmediği durumlarda geçerlidir. NH3, SO2, SO3, NO2, CO2, Cl2 gibi gazlar özellikle suda kimyasal değişmelere uğrarlar. Bu yüzden böyle gazların Henry Yasası'na uydukları söylenemez.
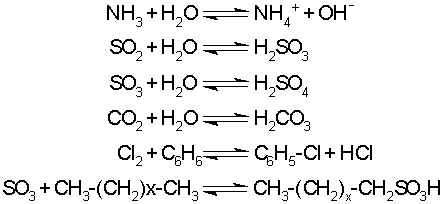
Buna karşılık; NO, CO, N2, O2, H2 ve asal gazlar suda fiziksel etkileşim kuvvetleri sayesinde çözünürler ve kimyasal reaksiyon vermezler. Çözünürlükleri ile ilgili deney ve hesaplar Henry Yasası'na göre yapılabilir.
Avagadro Yasası
Bu yasa, Dalton Atom Hipotezi'nin açıklamakta yetersiz kaldığı gaz fazı reaksiyonlarını izah edebilmek gayesi ile Avagadro tarafından teorik bir yaklaşım olarak teklif edilmiş, daha sonra deneyle ispatlanmıştır. Avagadro Yasası; "Aynı sıcaklık ve basınçta bütün gazların eşit hacimlerinde eşit sayıda molekül bulunur" şeklinde ifade edilir. Buna göre, 00C'de ve 1 atmosfer basınçta bütün gazların 1 molü 22,414 litre hacim kaplar ve bu hacim içinde 6,023 ×1023 gaz atom veya molekülü vardır.
3 farklı gaz türünün bir kapta uyguladıkları basınçları görmektesiniz. Gaz türlerini butonlara basarak etkisiz hale getirin ve gazların bireysel olarak toplam basıncı nasıl etkilediğini gözlemleyin.
Derecenin üzerindeki kırmızı oku yukarı aşağıya oynatarak sıcaklığı değiştirin ve hacme etkisini gözlemleyin.