Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















Her molekül serbest bir cisim gibi, doğru bir yol üzerinde hareket eder. Molekül, içinde bulunduğu kabın çeperlerine veya başka bir moleküle çarptığında hareketin doğrultusu bir anda değişir ve başka düzgün bir hareketle başka bir doğrusal yol izlenir.
8.2.3 Gazların Kinetik Teorisi
Gazların kinetik teorisi gazların davranışlarını açıklamak için geliştirilmiş ve gazların gözlenen makro özelliklerini açıklamada başarı ile kullanılmıştır. Daha sonra sıvı ve bazı katı faz özelliklerinin açıklanabilmesi için de faydalı yaklaşımlar sağlamıştır. Öncelikle; moleküllerin mutlak büyüklükleri ve Avagadro sayısı hakkında ilk kesin bilgiler Kinetik Teori yardımı ile elde edilmiştir.
Kinetik teori bazı varsayımlara dayanır:
- Madde, kesikli bir yapıya sahiptir ve cisimler, kütleleri ne kadar az olursa olsun, çok sayıda molekülden ibarettir.
- Moleküller gayet küçük birer maddesel nokta halinde, esnek kürecikler biçimindedir.
- Moleküller devamlı surette öteleme hareketinde bulunurlar. Öteleme hareketi, moleküllerin ağırlık merkezleri çevresinde dönmelerine ve moleküllerin içindeki atomların titreşimlerine engel değildir.
- Her molekül yalnız gazın cinsine ve sıcaklığa bağlı bir hızla, serbest bir cisim gibi, doğru bir yol üzerinde hareket eder. Molekül, içinde bulunduğu kabın çeperlerine veya başka bir moleküle çarptığında hareketin doğrultusu bir anda değişir ve başka düzgün bir hareketle başka bir doğrusal yol izlenir.
Bir molekülün iki çarpışma arasında aldığı yola serbest yol denir. Belli bir gaz için, belli sıcaklık ve basınçta moleküllerin serbest yolları ortalama bir değer dolayında değişir ki buna ortalama serbest yol denir.
Gaz hali için bir başka önemli büyüklük de kinetik enerjidir. Kütlesi m, hızı v olan bir molekülün ortalama kinetik enerjisi 1/2mv2 dir. Kinetik Teori'ye göre; bir gazın toplam enerjisi moleküllerin kinetik enerjileri toplamına eşittir. Çarpışmalar yoluyla her molekülün enerjisi sürekli değişir. Bu çarpışmalar esnektir, çarpmadan sonra ve önceki kinetik enerji toplamı sabittir. Başka deyişle gazın toplam Ek değeri değişmez.
Moleküllerin kendi aralarındaki çarpışmalarının yanında, bulundukları kabın çeperine olan çarpışmaları da vardır ve gaz basıncı olarak ortaya çıkar. Basınç-
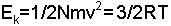
eşitliği bulunur. Sabit sıcaklıkta, moleküllerin hızları mol tartısının kare kökü ile ters orantılıdır. Örneğin, oksijen hidrojenden 16 kat daha ağır olduğundan, hızı da hidrojene nazaran 4 kat daha azdır. Bir tek molekülün kinetik enerjisi ise,
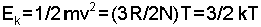
eşitliği ile gösterilir. Genel gaz sabitinin Avagadro sayısına oranı (k= R / N) alınarak elde edilen yeni sabite Boltzmann sabiti adı verilir ve değeri 8,314x107 / 6,02x1023 = 1,38x10-
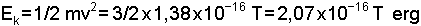
yazılabilir. Görüldüğü gibi, ideal bir gazın kinetik enerjisi sadece sıcaklıa bağlıdır.
İdeal gazlar PV = n×RT hal denklemine uyarlar. Bu denkleme uymayan gazlara ise gerçek gaz denir ve tüm gazlar gerçek gazdır.
8.2.4 Van Der Waals Denklemi
İdeal gaz, molekülleri arasında esnek çarpışmalar dışında karşılıklı hiçbir etkileri olmayan; molekül hacmi gazın kapladığı hacim yanında ihmal edilebilen teorik bir gazdır. Daha önce de görüldüğü gibi, böyle bir gaz PV = n×RT hal denklemine uyar ve enerjisi yalnız sıcaklığa bağlıdır. PV = nRT hal denkleminden sapma gösteren, başka deyiş ile kinetik teori varsayımlarına uymayan gazlara gerçek gaz adı verilir. Bütün gazlar gerçektir. Gerçek gazların hal denklemini bulmak için;
Gaz atom ve moleküllerinin ne kadar küçük olursa olsun bir kütlesi ve dolayısıyla bir öz hacmi olduğunu, Gaz atom ve moleküllerinin arasındaki; temelde fiziksel etkileşim kuvvetleri olan, Kohezyon ve Adhezyon kuvvetlerini, göz önüne almak gerekir. Kohezyon aynı cins, Adhezyon farklı cins moleküller arasındaki çekme kuvvetleri için kullanılmaktadır.
Bu değerlendirmeler ışığında birçok hal denklemi önerilmiştir. En çok bilinen Van der Waals Hal Denklemi'dir. n mol gaz için Van der Waals denklemi,
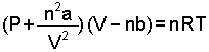
şeklindedir. Denklemde a basınç katsayısıdır ve moleküller arası kütle çekiminden doğan etkilere karşılık gelir. b bastırılamayan hacim katsayısıdır, atom ve moleküllerin öz hacimlerinin bir ölçüsüdür. a ve b sayıları her gaza özgü farklı değerler alan yapısal sabitlerdir.
8.2.5 Joule -
İdeal gazlarda moleküller arasında herhangi bir etki, bir çekim kuvveti yoktur. Böylece bu gibi gazlar kendileri dışındaki bir sistem ile ısı alış verişi olmaksızın boşluğa doğru genişletilecek olurlarsa molekülleri ayırmak için bir enerji harcanmaz ve sıcaklık değişmesi görülmez. Oysa gerçek gazlarda durum farklıdır ve moleküller arasında bir çekme kuvveti olduğundan, genişleme izole edilerek yapılacak olursa molekülleri birbirinden ayırmak için gerekli olan enerji bizzat kendilerinden alınacağından bir soğuma olur. Adyabatik (ısı alışverişi olmaksızın) genişletilmesi ile sıcaklıklarının düşmesi Joule-
Gazları sıvılaştırmak öncelikle soğutulmaları sonucunda ve basınç uygulamakla gerçekleşir. Gaz sürekli olarak bastırılıp genişletilir. Bastırma enerjisi dışarıdan verilir. Genişlemede ısı alışverişi olmadığı için gaz molekülleri kinetik enerjilerini kaybeder ve dolayısıyla gaz, ısı kaybına uğrayarak soğur. Linde adı ile bilinen cihazlarda yapılan bu işlemlerde her gaz için karakteristik olan kritik sıcaklığın altına kadar soğutulan gaza basınç uygulanarak sıvılaştırılır.
Bir gazı sıvılaştırabilmenin ilk şartı o gazın kritik sıcaklığının altına inmektir. Bu sıcaklık derecesinin üzerinde bulunan bir gaza çok yüksek basınçlar uygulansa bile sıvılaştırılamaz.
8.3. Sıvılar
Sıvılar gazlar gibi belirli bir şekil almaz, ancak belirli hacimleri vardır. Sıvı atom ve molekülleri arasında boş hacimler son derece küçüktür. Bu yüzden sıvılardaki molekül hareketleri sınırlıdır. Ancak yapılan öteleme hareketleri gazlardakine çok benzer.
Genelde her sıvının üzerinde o sıvının gaz fazı bulunur. Belirli bir sıcaklıkta sıvı ve gaz fazı dengededir. Bu fizik denge şöyle açıklanır. Birim zamanda sıvıdan gaz fazına geçen molekül sayısı, gaz fazından sıvıya dönen molekül sayısına eşittir.
8.3.1 Kaynama ve Donma Noktası
Ağzı açık bir kap içinde bulunan bir sıvı ısıtılırsa yavaş yavaş buharlaşmaya başlar. Her dT sıcaklık aralığında sıvı üzerinde yeni bir dinamik denge oluşur. Buhar basıncı dış atmosfer basıncına eşit olduğunda denge daha fazla oranda gaz faz lehine döner ve kaynama görülür. Bu sıcaklık o sıvıya ait kaynama noktası'dır. Kaynama noktasına gelen bir sıvı ısıtılmaya devam edilse de sıcaklığı yükselmez ve sabit kalır. Ancak buharlaşan sıvı miktarı artar. Kaynama noktası sadece sıvı üzerindeki basınca bağlıdır. Örneğin, su 760 mm Hg basıncında 100 0C'de kaynar. Dış basınç 17 mm Hg değerine düşürülürse su 20 0C'de kaynayacaktır. O halde sıvının kaynama noktası verilirken hangi basınçta olduğu mutlaka verilmelidir.Bir sıvının kaynama noktasına ulaşıldıktan sonra verilen ısı, sıvıyı buharlaştırmak için harcanır. Kaynama noktasında buharlaştırma için sarfedilen ısıya buharlaşma ısısı sıvının 1 gramını buharlaştırmak için gereken ısıya da spesifik buharlaşma ısısı denir. 1 mol sıvının buharlaştırılması için gereken ısıya da molar buharlaşma ısısı adı verilmektedir.
Donma Noktası
Sıvıların ısıtılmalarının yanı sıra soğutulmaları da hal değişikliğine sebep olur. Soğutulan sıvılar sabit bir sıcaklıkta katı fazı oluşturur. Bu, sıvının donma noktasıdır. Donma noktasında maddenin gaz, sıvı ve katı fazları dinamik bir denge dahilinde bir arada bulunur. Katı haldeki 1 g maddeyi sıvı hale geçirmek için gereken ısı miktarına spesifik erime ısısı denir. Örneğin, 1 g buzu 00C'de sıvı hale geçirmek için 80 kcal sarf edilir. Donma ve erimeye basınç etkisi pratikte ihmal edilir.
8.3.2 Yüzey Gerilimi
Sıvılarda molekülleri bir arada tutan kohezyon kuvvetleri gazlara göre çok büyüktür. Bu yüzden sıvıların yüzeylerinde bulunan moleküller sıvı içine doğru çekilirler. Bu suretle sıvılar birim hacimde mümkün olabilen en küçük yüzeyi almaya çalışırlar. Yağmur damlalarının küresel oluşları buna bir örnektir. Çünkü küre, hacmine nazaran yüzeyi en küçük olan geometrik şekildir.Sıvıların yüzeyindeki bu kohezyon kuvvetinin birim uzunluktaki değerine yüzey gerilimi denir. Örneğin CGS birim sisteminde yüzey gerilim dyn/cm olarak gösterilir. kuvvet/uzunluk cinsinden ifade edilir.
Vizkozite
Sıvıları karakterize eden diğer bir fizik özellik vizkozitedir. Vizkozite genel anlamda bir sıvı yüzeyinin diğer bir yüzeyde hareket ederken karşılaştığı dirençtir ve
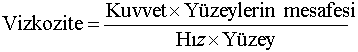
eşitliği ile belirtilir. Birimi;
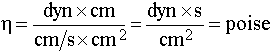
olarak bulunur.