Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















8.4 Katılar
Bastırılabilme ve akışkanlık gazların en önemli özellikleridir. Gazların makroskopik davranışının, birbirinden bağımsız moleküllerin karmakarışık şekildeki hareketlerine dayanarak nasıl açıklanabildiğini moleküllerin kinetik teorisini incelerken görmüştük. Kristal halindeki katıların en göze çarpan özellikleri ise, gazlardan farklı olarak, bunların sert olmaları, bastırılamamaları ve karakteristik bir geometriye sahip olmalarıdır. Katıların bu makroskopik özelliklerini, Atom Teorisi'ne dayanarak, ancak kristal örgüsü kavramını kabul etmekle açıklayabiliyoruz.Oldukça büyük kuvvetlerle sürekli olarak atomların bir arada tutulduğu düzenli yapıya kristal şebekesi ya da kristal örgü adı verilir. Buna göre katılar ve gazlar moleküllerinin davranışı yönünden, iki zıt kutup olarak kabul edilebilir. Gazlarda moleküller arasındaki kuvvetler yok denecek ölçüde küçüktür ve moleküller bir kaos (karmaşa) halindedir. Katılarda ise moleküller arasındaki kuvvetler büyüktür ve sisteme düzen hakimdir.
8.4.1 Katıların Genel Özellikleri
Sertlik ve bastırılabilme özelliklerinin yanında, doğal karakteristik geometrik şekiller de gösteren bazı maddeler vardır; bunlar arasında örneğin sodyum klorürü, şeker ve kükürdü sayabiliriz. Kristal katılar adını verdiğimiz bu maddeleri cam, lastik veya diğer plastikler gibi amorf maddelerden iyice ayrıdetmek gereklidir. Bu amorf maddeler bazı mekanik özelliklere sahiptirler, fakat şekilleri karakteristik ve düzenli değildir. Amorf maddeler izotropiktir; (İzotropik maddelerin mekanik dayanıklılık, kırınım indisi ve elektriksel iletkenlik gibi özellikleri, kütlenin her yönünde aynıdır) Bu özellik, aynı zamanda, sıvı ve gazlarda da kendini gösterir.Kristal katılar ise bunlardan farklı olarak anizotropiktir; (Anizotropik maddelerde elektriksel ve manyetik büyüklükler genellikle ölçüldükleri yöne göre farklıdır) Kristal ve amorf yapılı maddeler arasındaki en belirgin diğer bir farklılık, erime noktasıdır. Kristal katıların kesin ve sabit erime noktaları vardır; bir kristal madde ısıtıldığında mekanik özellikleri belirli bir sıcaklığa kadar çok az ölçüde değişir ve bu sıcaklıkta birdenbire eriyerek sıvılaşır. Amorf maddelerin ise erime noktaları belirli değildir. (Örneğin cam, sıcaklık arttıkça sürekli olarak yumuşar, giderek viskozitesi azalır ve sonunda akışkan olur. Belirli erime noktalarının bulunmaması, cam ve diğer amorf maddelerin bütün sıcaklıklarda sıvı olarak kabul edilmesine yol açar.)Amorf maddelerin atomları, kristal şebekelerde görülen düzeni değil, sıvılar içi karakteristik olan düzensizliği gösterirler. Böyle amorf katıları viskozitesi çok yüksek sıvılar olarak düşünmek yanlış olmaz. Bu yüzden katı sözcüğünün bilimsel anlamda olduça genel bir kavram olduğu anlaşılır. Elementel kükürt gibi bazı maddelerin hem kristal hem de amorf yapıları vardır. Her iki yapı şekli sadece bazı fiziksel özellikler bakımından farklılık gösterir. Bunlar kimyasal bakımdan aynı özelliklere sahiptirler.
8.4.2 Kristal Katılar
Kristal maddelerdeki anizotropi ve karakteristik geometrik şekil gibi makroskopik özellikler düzenli bir yapının sonucudur. Böyle maddelerin ince yapısını açıklamak, atom, iyon ve moleküllerin nasıl ve ne şekilde birarada bulunduklarını ortaya koymakla mümkündür. Bu amaç için kristallerin oluşumunu ve düzenlerini gerçeğe yakın ölçüde tanımlayan bir model gerekecektir. Modelin dayandığı temel ise düzenli bir örgü yapısını öngörmüş olmalıdır. Kristal yapılı bir katı, atom veya iyonları temsil eden istiflenmiş küreler gibi düşünülebilir. Böyle bir sık istiflenmiş küre modeli oldukça kullanışlıdır. Metal yapı şekillerini(Strüktür, structure) ve diğer sık istiflenmiş yapıları tartışmada genel bir taslak olarak kabul edilebilir.
Bilinen kristal katı türlerini
- iyonik,
- moleküler,
- kovalens ve
- metalik
kristal türleri olmak üzere 4 grupta incelemek mümkündür.
8.4.2.1 İyonik Kristaller
İyonik kristaller teorik ve denel inceleme bakımından önemli kolaylıklar sağlamakta, türetilen bilgiler diğer gruplar için de gerçekleştirile bilmektedir. Bu bakımdan iyonik kristaller üzerinde daha geniş ve detaylı çalışmalar yapmak gerekmektedir.
İyonik kristallerde örgübirimleri negatif ve pozitif yüklenmiş taneciklerdir. Bunların örgü içindeki potansiyel enerjileri, birbirinden sonsuz uzak oldukları durumdakine oranla daha küçüktür. Yükü aynı olan her iyonun örgü içinde eşdeğer bir yer işgal ettiğini, kristal içinde herhangi bir atom gruplaşmasının ya da moleküllerin mevcut olmadığını önemle belirtmek gerekir.
Gerçekte, belirli yükü olan her iyon, ters işaretli bütün iyonlara coulomb kuvvetleri ile bağlanmıştır. İyonik bir örgüyü ayırarak buharlaştırmak için gerekli enerji 200 kcal/mol büyüklüğündedir. Bu oldukça büyük bir bağ enerjisi sayılır. Oda sıcaklığında, iyonik kristallerin buhar basınçlarının ihmal edilebilecek kadar küçük olmasının, bunların ancak yüksek sıcaklıklarda eriyebilmelerinin ve kaynayabilmelerinin nedeni budur. Tipik bir iyon kristal bu gibi özellikleri ile diğer kristal türlerinden ayrılır.
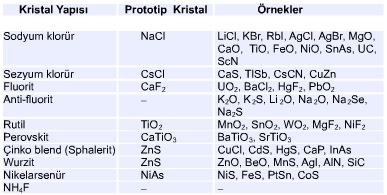
Bazı iyonik yapılar birçok katı için prototip niteliğine sahiptirler. Örneğin, sodyum klorür mineral adı olmasına rağmen, benzer birçok iyonik kristal için bir yapı tipini de ifade eder. İyonik kristal yapıların belli başlı türleri tabloda özetlenmiştir.
8.4.2.2 Kovalens ve Moleküler Kristaller
Kovalens bağlardan oluşan kristal örgülerin kırılması da çok güçtür. Kovalens bağlarla birbirine bağlı karbon atomlarından oluşan elmas ve grafitin erime ve kaynama sıcaklıkları çok yüksektir.Karbon dioksit ve silisyum dioksit merkez atomları karbon ve silisyumun ikişer oksijen atomuna bağlı olduğu bileşiklerdir. Bunlarda CO2'de karbon-
Kırmızı fosforun, köşelerinde fosfor atomları bulunan tetrahedrallerden oluşan bir polimer yapıda olduğu söylenebilir. Kırmız fosfor gaz haline geçerken tetrahedral düzendeki P4 yapısı bozulmaz. Ancak tetrahedral birimler arasındaki bağlar kırılır. Katı halden gaz haline geçişte büyük bir yapı değişikliği olmadığından, kırmızı fosfor düşük sıcaklıkta süblimleşir.

Kovalens ve Moleküler Kristallerin erime ve kaynama sıcaklıkları gösteriyor