Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















7.3.2.3.1 Pauling ve Mulliken Elektronegativite Tanımları
Pauling Elektronegativite Tanımı
Pauling elektronegativiteyi tanımlamak için molekülde kısmi yüklerin oluşumu ile meydana gelen bağ enerjisindeki artıştan faydalanmıştır.
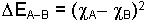
EA-
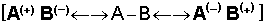
ileri gelir. İyonik rezonans enerjisi aynı zamanda,
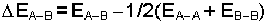
eşitliği ile de hesaplanabilir:
Formüldeki EA-
Buna göre; Pauling elektronegativite değerlerini hesaplayabilmek, iki atomlu bir molekülde atomlardan birinin elektronegativitesini bilmekle mümkün olmaktadır.
Mulliken Elektronegativite Tanımı
Mulliken'e göre elektronegativite, iyonlaşma enerjisi ile elektron ilgisinin aritmetik ortalamasıdır.
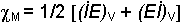
(İE)V ile (Eİ)V atomun valens hali iyonlaşma enerjisi ve elektron ilgisidir. Valens hali bir atomun diğer bir atom ile etkileşime girdiğinde; orbitallerini kimyasal bağ yapmak üzere düzenlediği eksite durumdur. O halde; (İE)V ve (Eİ)V uyarılmış haldeki atomun iyonlaşma enerjisi ve elektron ilgisidir.
7.3.2.4 Polarizasyon ve Deformasyon
Polarizasyon pozitif yüklü katyonların negatif yüklü anyonların elektron bulutlarını elektrostatik olarak etkilemesi şeklinde tanımlanır. Özellikle, Cu2+, Zn2+, Sn2+, Hg22+, Hg2+, Ag+ gibi yarıçapları küçük ve etkin çekirdek yükleri (Z*) rölativ büyük, dolayısıyla yoğun pozitif yüke sahip katyonlar, anyonik yapıdaki iyonların kendilerine göre daha hacimli olan orbitallerini kendilerine doğru çekerler. Bu etkileşme sonunda (-
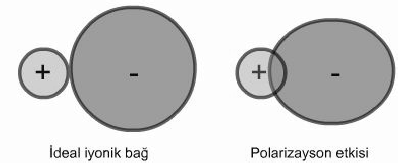
Bu açıklamalarla; katyonların yük/yarıçap oranının büyümesi ile polarizasyon güçlerinin arttığı, anyoların yük/yarıçap oranının büyümesi ile de daha kolay deformasyona uğrayabilecekleri sonucu çıkmaktadır.Polarizasyon sebebiyle iyonik yapıdaki bağlar ideal halden saparlar. Negatif yük katyona normalden daha fazla yaklaşır ve iyon bağının enerjisi artar. Bu şekilde iki iyonun orbitalleri iyonik bağ için gerekenden daha büyük oranda ilave bir girişim yaparak ideal iyonik bağda mevcut olmayan bir durumu ortaya çıkarır. Bu orbital girişimi görünür alanda bir ışık absorbsiyonuna sebep olur ki, böyle bileşiklerin renkli oluşları polarizasyon etkisi ile açıklanır. Gümüş halojenür bileşiklerinde polarizasyon etkisi açık bir şekilde görülür.
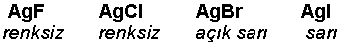
Fluordan iyoda doğru halojenlerin orbital hacimlerinin (yük/yarıçap oranlarının) büyümesi sonucu AgBr ve AgI bileşiklerinde Br ve I iyonlarının Ag'ün polarizasyon etkisi ile deformasyonu daha belirgin hale gelmektedir.
7.3.2.5 Polar Kovalens Bağ
Kovalens bağlı bileşiklerde atomların elektronegativiteleri az da olsa farklı ise, bağ elektronlarının yoğunluğu her iki atoma eşit uzaklıkta değildir. Elektronlar elektronegativitesi yüksek olan atomda bulunma eğilimini daha fazla taşırlar ve bu sebeple, bu atom üzerinde negatif yük artması meydana gelir. Buna karşılık diğer atomda negatif yük fakirleşmesi sonucu pozitifleşme görülür. Kovalens bileşiklerde moleküller tüm olarak nötral yapılardır, söz konusu edilen yük artması ve azalması hiçbir zaman bir tam yüke (4.8 10-
Klor ve hidrojen gibi aynı elementten meydana gelmiş diatomik moleküllerde, bağ elektronlarının elektron yoğunluğu elektron ilgileri dolayısı ile elektronegativiteleri eşit olduğu için iki atomun arasında hemen hemen homojen dağılmıştır. Bu moleküle pratikte bir elektrik yükü simetrisi sağlar. Pozitif yükün ağırlık merkezi negatif yükün ağırlık merkezi ile aynıdır. Böyle bir moleküle apolar molekül denir.
Böyle bir molekül elektrik alanda yönelmez. Oysa iki farklı atomdan meydana gelen ve yine kovalens bağlı bir bileşik olan HCl molekülünde klor atomu ortak elektron çiftini hidrojen atomuna göre daha büyük bir kuvvetle çeker. Elektron çifti klor atomuna daha yakındır ve molekül bakımından simetrik değildir, molekülün klor yanı kısmi negatif(-
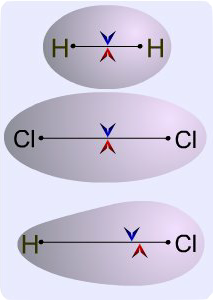
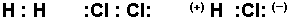
Mavi ok pozitif, kırmızı ok ise negatif yüklerin merkezini göstermektedir. İlk iki bağ örneği apolar üçüncüsü ise polardır.
Elektrik alanın içinde HCl molekülünün klor tarafı pozitif yüklü levhaya, hidrojen tarafı da negatif yüklü levhaya doğru yönlenir. O halde HCl molekülündeki kovalens bağ polarize, molekül de polar moleküldür. Buna göre, hidrojen ile klor arasındaki bağ polar kovalens bağdır.
7.3.2.6 Moleküllerin Polarlığı
Polar moleküller aynı zamanda dipol kavramı ile de tanımlanır. Elektrik yükü (q) ile yüklerin ağırlık merkezleri arasındaki uzaklığın (r) çarpımı dipol momenti (= q .r) verir. Birimi, esyb. cm olup 10-
Kovalens bağlar vektörel (yönelmiş) kuvvetler olduklarından molekülde bağ kuvveti oksijen atomlarına doğru yönlenmiştir. Oksijen atomları eşit oranda kısmi (-
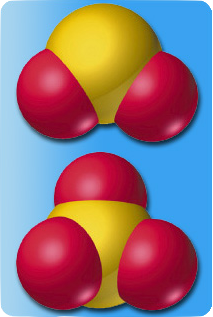
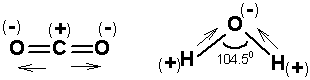
Karbondioksidin dipol momentinin sıfır olması simetrik yapıda olduğunu gösterir. Su molekülünün bir dipol momente sahip olması ise açısal yapısını ortaya koymaktadır.
İki farklı molekülun bağlarının 3 boyutlu görünümü.