Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















7.3.2 Kovalens Bağlar
Kovalens bileşikler teorisi G.N. Lewis tarafından önerilmiş (1916), Langmuir tarafından geliştirilmiştir (1919). Kovalens bağ, elektron ilgileri birbirine yakın değerler alan atomlar arasında elektron çiftleşmeleri ile meydana gelir. Çiftleşme kavramı ile anlatılmak istenen; bağa katkı sağlayan elektronların her iki atoma da elektron ilgilerinin büyüklüğüne göre belirli oranlarda ait olduğudur. İyonik bağda olduğu gibi, atomlar bileşiklerinde bir asal gazın elektronik düzenini almaya eğilimlidirler.Okted Kuralı olarak bilinen asal gaz elektron düzenini alma hali, bağın meydana gelmesi için gerek şart değildir, sadece bağın kararlılığı için bir parametredir. Okted kimyasal yapıya ilave bir kararlılık getirir. Ancak okted kuralının sağlanmadığı birçok kararlı bileşik bilinmektedir.
Kovalens bağda okted; elektronların ortak kullanımı sayesinde, her iki atomun dışında meydana gelir. Bu nedenle kovalens bağda oktedler, iyonik bileşiklerde olduğu gibi bağımsız değildir. Bazı örnekler Lewis nokta yapısı ile aşağıdaki gibi gösterilebilir.
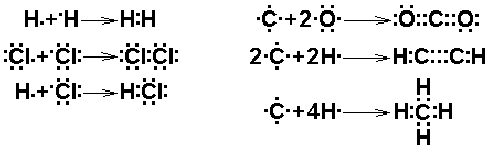
Alışılan yazılış şeklinde, iki atom arasındaki bir elektron çifti bir çizgi ile gösterilir ve bu bir bağı temsil eder. İki elektron çifti çift bağa, üç elektron çifti üçlü bağa karşılık gelir.
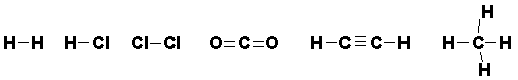
Kovalens bağ, elektron bulutu modeline göre de gösterilebilir. İki atom birbirine oldukça yaklaşınca, iki bulut birbiriyle kısmen girişim yaparak iki çekirdek arasında yüksek bir elektron yoğunluğu ile karakterize olan bir kovalent bağ verir. O halde H-
- Erimiş halde elektrik yalıtkanlığı,
- Erime ve kaynama noktalarının düşüklüğü,
- Dielektrik sabiti düşük çözücülerde kolayca çözünme ve
- Yapı taşlarının moleküllerden ibaret olması.
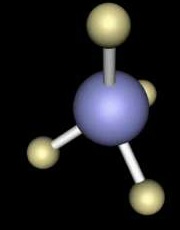
Üstte çubuk altta ise bulutumsu metoduyla gösterilen CH4molekülünü görmektesiniz.
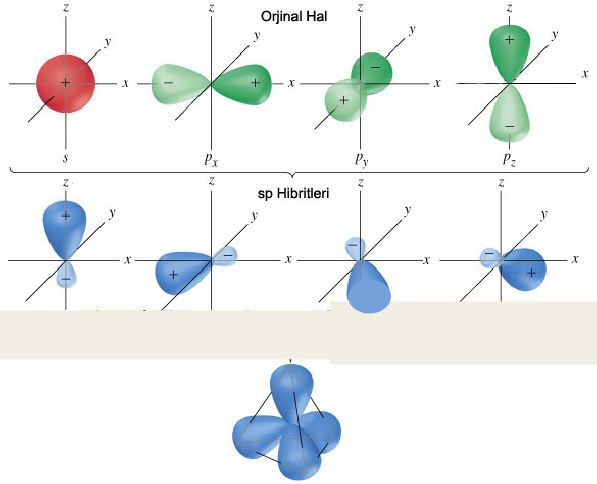
7.3.2.1 Hibridizasyon
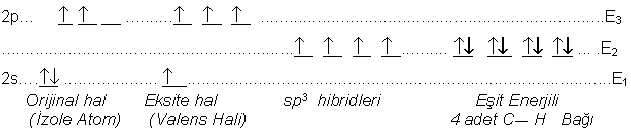
Farklı ya da aynı türden iki atom arasında meydana gelen kimyasal bağlar Moleküler Orbital Teorisi çerçevesinde izah edilebilmektedir. Ancak bağın oluşabilmesi için bir takım enerjitik değişikliler gerçekleşmelidir. Bilindiği gibi her atom kendine özgü orbital düzenine sahiptir. Atom reaksiyon için uyarıldığında, elektronlar bir üst enerji düzeyine geçerek paralel spin ile yerleşirler. Daha sonra yarı-
Hibridizasyonu enerji boyutunu da dikkate alarak Metan (CH4) örneğinde; şemada olduğu gibi göstermek mümkündür. Karbon atomunun temel haldeki elektronik dizilişi; 1s2 2s2 2p2 şeklindedir. Hibridleşme 2s ile 2p orbitalleri arasında geçekleşir ve görüldüğü gibi hibridlerin enerjisi 2s ile 2p enerjilerinin ortalamasıdır.
7.3.2.2 Rezonans
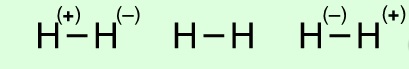
Dalga mekaniğinin moleküler yapı teorisi için sağladığı en büyük katkılardan biri rezonans enerjisi kavramıdır. Örneğin en dış orbitallerinde birer elektronu bulunan A ve B atomlarını düşünelim. AB molekülünde her bir elektron kendi atomunun orbitalinde bulunabildiği gibi, öteki atomun orbitaline de geçebilir, yani A atomunun elektronu B atomununkine, B atomununki de A atomunun orbitaline geçebilir. Bu iki yapı statik değildir, molekül bir halden diğerine devamlı bir gidiş geliş halindedir. Hidrojen molekülü (H2) örneğinde bu durum aşağıdaki gibi gösterilebilir.
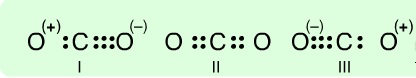
Bu salınma sonucu molekül birçok rezonans yapısına sahip olabilir. Bunlardan her birinin toplam enerjisi esas itibarı ile bir ötekininkinin aynıdır. Bir karbondioksit molekülü şu eşdeğer yapılara sahip olabilir:
Uzun zaman II yapısının hakim olduğu, I ve III yapılarının pratik olarak bulunmadığı kabul edilmişse de, günümüzde her üç rezonans formülünün birlikte bulunduğu denel verilerin de desteği ile kabul edilmiştir.
7.3.2.3 Elektronegativite
Elektron ilgisi, elektron alma eğiliminin bir ölçüsüdür ve atomların elektron çekme gücü olarak tanımlanabilen bağımsız bir atomik özelliktir. Elektronegativite ise bir molekül içindeki atomların bağ elektronlarını çekme gücüdür. O halde, elektronegativite atomun bağımsız bir özelliği değildir, ancak bir başka atom ile arasında kimyasal bağ meydana geldiğinde ortaya çıkan bir büyüklüktür. Bu tanıma göre, bir atomun elektronegativite değeri sabit olmayıp, molekül oluşturduğu atoma bağlı olarak değişecektir.
Elektronegativitenin hesaplanmasında farklı metodlar kullanılabilir. Bunlardan en çok tercih edilen ikisi; Pauling ve Mulliken tarafından önerilenlerdir.