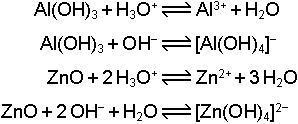9.3.4 Çözeltilerin Asitliği ve Bazlığı
Bir çözeltideki asidite (asidlik ölçüsü) H+ iyonu (daha doğru olarak H3O+) molar konsantrasyonu ile belirlenir ve logaritmik terim "pH" ile ifade edilir. Bir çözeltinin pH değeri;
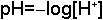
denklemi ile hesaplanır. İdeal seyreltiklikteki çözeltiler için pH 0 ile 14 arasında değer alabilir.
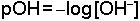
yazılabilir ve kuvvetli bazik çözeltiler için kullanılabilir. İdeal bir çözeltide;
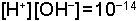

eşitlikleri geçerli olacaktır.
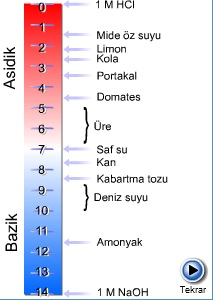
Bazı çözelti ve doğal ortamların pH değerleri.
9.3.5 pH İndikatörleri
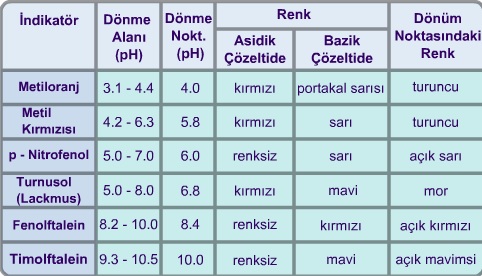
İndikatörler bir çözeltinin Hidrojen iyonlarının konsantrasyonuna göre belirli bir renk veren ve zayıf asit veya zayıf baz özelliği taşıyan organik boyar maddelerdir. Bir boyar maddenin indikatör olarak kullanılabilmesi için renk değişmesinin oldukça dar bir pH alanında meydana gelmesi gereklidir. Bir indikatörün etki şekli, gözlerimiz için renk farkı meydana gelmesine olanak sağlayan bir pH alanına bağlıdır. Bu sebepten, bir indikatörün renk bakımından biri bazik ve diğeri asidik alanda olmak üzere iki sınır değeri vardır. Bu iki sınır değeri arasındaki pH alanı indikatörün dönüm alanını gösterir (Tablo 9.5). Bu dönüm alanı her indikatör için farklı olup kendine özgüdür. İndikatörler belli bir pH alanında disosiye olurlar ve renk değişmesi disosiyasyona bağlı olmayıp, bununla birlikte meydana gelen yapı değişimine dayanır.
Örneğin Fenolftaleini göz önüne alarak bir indikatörün etki şeklini aşağıdaki gibi gösterebiliriz.
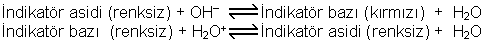
Bazı indikatörler ve pH özellikleri
9.4 Hidroliz ve Amfoterlik
Brönsted-Löwry Asit-Baz tanımına göre bir asidin su ile reaksiyonu
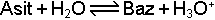
genel denklemi ile gösterilir. H2O asitten proton aldığı için bazdır. Ancak su bazlara karşı da asit özelliği gösterebilmektedir.
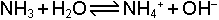
Bu halde suyun konjuge bazı OH- iyonu olur. O halde H2O hem asit hem de baz özelliğine sahiptir. Böyle maddelere amfolit veya amfoter maddeler denir.Periyodik cetvelin orta bölümlerinde yer alan metallerin oksit ve hidroksit bileşikleri en çok bilinen amfoter maddelerdir.
Bölüm Özeti
Bu bölümde;
- Fiziksel karışımların türleri,
- Homojen ve heterojen karışımların genel özellikleri,
- Kolloidal çözeltilerin özellikleri,
- Çözünürlük ve çözünürlük çarpımının anlamı,
- Molarite ve diğer konsantrasyon birimleri,
- pH kavramı ve asit-baz teorileri,
- Ebülyoskopi, Kriyoskopi ve Osmotik Basınç
incelendi.
Hidrolizin gerçekleştiği anorganik bileşiklerin çözeltileri genellikle bulanık görülür.
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
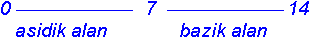

 Genel Kİmya konlarI Geri
Genel Kİmya konlarI Geri
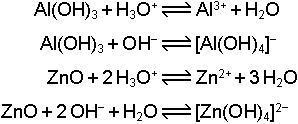






















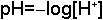
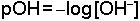
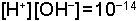

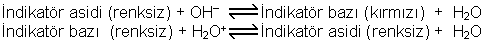
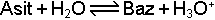
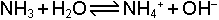 Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
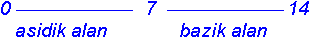

 Genel Kİmya konlarI Geri
Genel Kİmya konlarI Geri