Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















Kimyasal Denge
Bütün fiziksel ve kimyasal değişmeler, değişmede rol alan kimyasal yapıların kimyasal ve fiziksel özellikleri de dahil olmak üzere bir takım faktörlere bağlı olarak meydana gelirler.Değişmelerde birim zamanda değişime uğrayan madde miktarı değişmenin hızını verir. Hızın büyüklüğüne göre, belirli bir süre sonra değişme sonucunda oluşan madde veya maddelerin sistem içinde belirli bir çokluğa ulaşmasıyla reaksiyon hızı sıfıra yaklaşır. Böylece değişime uğrayan ve değişim sonucunda oluşan maddeler sistem içinde az veya çok miktarlarda bulunurlar. Bu şekilde oluşan sistem denge halindedir.
Bölüm Hedefi
Bu bölümü tamamladığınızda;
- Kimayasal ve fiziksel değişmeleri,
- Kimyasal rekasiyonları sınıflandırmayı,
- Kimyasal dengenin matematik tanımını,
- Kimyasal dengenin türlerini,
- Kimyasal dengeyi değiştiren etkenleri
öğrenmiş olacaksınız.
10.1 Kimyasal Reaksiyonlar
Kimyasal reaksiyon, kısaca; element veya bileşiklerin fiziksel ve kimyasal özelliklerinden az veya çok farklı başka element veya bileşikler vermek üzere uğradıkları değişmeler, şeklinde tanımlanabilir. Maddelerin yapısal özellikleri hakkında bilgi sahibi olabilmek için en geçerli yollardan biri kimyasal reaksiyondur. Bunun ilk örneklerinden biri, havayı oluşturan gaz karışımı oranının yanma reaksiyonu ile belirlenmiş olmasıdır. Yanmayı sağlayan bileşen olan oksijenin tüketilmesi ile hava hacminin 1/5 kadar azalması Lavosier tarafından bir kimyasal değişme sonucunda deneyle ortaya konmuştur. Kimyasal değişmelerin sistematik bir şekilde uygulanması; gerek karışımların gerekse saf maddelerin yapısal özellikleri ile ilgili bilgiler vermektedir
10.2 Kimyasal Reaksiyonların Sınıflandırılması
Çeşitli maddelerin elde edilmesinin yanı sıra, kimyasal özelliklerin incelenmesi ve bileşik türleri arasındaki ilişkilerin belirlenmesi, kimyasal reaksiyonların gerçekleştirilmesi ile mümkün olmaktadır.
Kimyasal reaksiyonların her türünün atom, iyon ve moleküllerdeki elektronların enerjitik konumlarının değişmesi ile meydana geldiği tartışmasız kabul edildiğine göre, reaksiyonları daha kolay açıklayabilmek ve dolayısı ile daha kolay anlaşılabilmelerini sağlamak amacıyla sınıflandırma yapmamız gerekir.
10.2.1 Reaksiyon Ortamına Göre Sınıflandırma
Sınıflandırmalardan biri değişmenin gerçekleştiği ortam dikkate alınarak yapılabilir. Kimyasal reaksiyonlar en kolay ve en iyi gerçekleştikleri ortamda yapılmak istenir. Uygun ortamlar genel olarak üç grupta toplanır ve faz kavramıyla tanımlanır. Gaz, sıvı, katı fazlar. Örneğin,
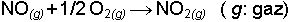
bir gaz fazı reaksiyonudur. Kobalt metaalüminat eldesi de katı fazda yürüyen kimyasal değişmeye örnektir:

Sıvı faz reaksiyonları ise daha çok karbon elementini içeren bileşikler arasında meydana gelir. Örneğin Asetanilid eldesi gibi. Şüphesiz, bir reaksiyonun her zaman tek fazda cereyan ettiğini düşünmek yanlış olur. Pek çok kimyasal değişme aynı zamanda faz değişimini de beraberinde getirir ve reaksiyon ortamı birden fazla faz bulunur.
Katı, sıvı ya da gaz fazlarından başka reaksiyonların yürüdüğü diğer bir reaksiyon ortamı çözelti fazı dır.
Çözücü kavramı altında kullanılan maddeler çok çeşitli olup Anorganik Ve Organik olmak üzere iki gurupta toplanırlar.Suyun çözücü olduğu reaksiyonlarda Latin dilinde su anlamına gelen aqua kelimesinin kısaltılması ile elde edilen (aq) sembolü kullanılır.
Görüldüğü gibi, bir reaksiyonun meydana gelmesi ile reaktanlar ve ürünler değişik fazlarda olabilmektedir. Hatta, çözücü ortamda bir faz olarak kabul edildiğinde bir kimyasal değişmenin dört fazı da içermesi mümkündür. Bu yüzden reaksiyonları tarif ederken ya da niteliklerinden bahsederken tek bir fazı dikkate almak her zaman doğru olmayabilir. Ancak, reaksiyonun başladığı fazı reaksiyon ortamı olarak kabul etme ve reaksiyonu o fazı belirterek tanımlama alışkanlığını sürdürmenin yanlış bir davranış olarak algılanmaması gerekir.
I-
10.2.2 Madde Türüne Göre Sınıflandırma
Reaksiyonlar için sıkça kullanılan diğer bir sınıflandırma reaksiyona giren maddelerin yapısal özellikleri göz önüne alınarak yapılabilir. Kimyasal bileşiklerin genel sınıflandırma şekli temel alındığında bu iki sınıf;
- Anorganik ve
- Organik Kimya Reaksiyonları
olarak şekillenir.
10.2.2.1 Anorganik Maddelerin Reaksiyonları
Anorganik Kimya Reaksiyonları ifadesi ile genellikle organik bileşik özelliği taşımayan bütün maddelerin reaksiyonları anlaşılabilir. İyonik yapılı bileşiklerin değişimleri, metal ve metal alaşımlarının reaksiyonları bu kapsama örnek olarak ilk akla gelenlerdir. Bununla beraber Anorganik Reaksiyon kavramı günümüzde metal ve hatta bir kısım ametallerin yer aldığı her reaksiyon için kullanılır hale gelmiştir. Özellikle Koordinasyon Kovalens Bağlı bileşiklerle (Na3[Co(NH3)6], K4[Fe(CN)6] gibi) ve Organometalik Bileşiklerin (CH3-
Özetlemek gerekirse, metal ve yarı metal içeren reaksiyonların tamamını Anorganik Reaksiyon saymakla büyük bir yanlış yapılmaz.
Anorganik karakterli kimyasal değişmeler mekanizmalarının temeli bakımından
- iyon değişimi ve
- redoks reaksiyonları
olarak iki kısımda incelenebilir.
10.2.2.1.1 İyon Değişimi ve Redox Reaksiyonları
İyon değişimi ile yürüyen reaksiyonlarda elementlerin değerliği değişmez, sadece atom ya da atom gruplarından ibaret anyon ve katyonlar eşleştikleri ters yüklü iyondan ayrılarak diğer bir ters yüklü iyonla birleşirler. Bu eşleşmelerde tek kural, aşağıda gösterilen örneklerde olduğu gibi elektronötralite'nin (yük eşitliğini ifade eden genel ilke) korunmasıdır.
Redoks reaksiyonları ise birden fazla elementin değerliğinin değiştiği reaksiyonlardır. Karşılıklı indirgenme (redüksiyon) ve yükseltgenme (oksidasyon) sırasında kimyasal yapı birimleri (atom, iyon ve moleküller) arasında elektron alışverişi meydana gelir.
Redox reaksiyonu
10.2.2.2 Organik Maddelerin Reaksiyonları
Organik Kimaya reaksiyonlarının işleyişleri oldukça farklı mekanizmalara dayanır. Sübstitüsyon ve Eliminasyon başlıca türlerdir. Buna ilaveten bir kısım organik reaksiyonlarda radikal denilen tek elektronlu kararsız yapılar ara üründür. Organik bileşikler arasındaki reaksiyonlar Bölüm 14'te daha ayrıntılı verilecektir.
Bir organik madde modellemesi


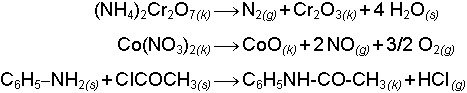
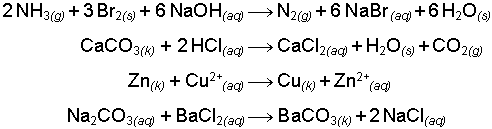 Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
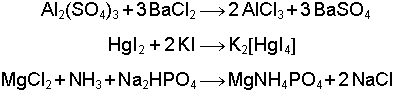

Bölüm -