






















10.3 Kimyasal Denge
Bütün fiziksel ve kimyasal değişmeler, değişmede rol alan kimyasal yapıların kimyasal ve fiziksel özellikleri de dahil olmak üzere bir takım faktörlere bağlı olarak meydana gelirler.
Değişmelerde birim zamanda değişime uğrayan madde miktarı değişmenin hızını verir. Hızın büyüklüğüne göre, belirli bir süre sonra değişme sonucunda oluşan madde veya maddelerin sistem içinde belirli bir çokluğa ulaşmasıyla reaksiyon hızı sıfıra yaklaşır. Böylece değişime uğrayan ve değişim sonucunda oluşan maddeler sistem içinde az veya çok miktarlarda bulunurlar. Bu şekilde oluşan sistem denge halindedir.
Fiziksel ve kimyasal dengeler dinamiktir. Denge; "birim zamanda sağa ve sola olan reaksiyon hızları eşittir, ya da birim zamanda bir yönde değişime uğrayan madde miktarı, aksi yönde değişime uğrayan madde miktarına ekivalendir" şeklinde tarif edilir.
Kimyasal sistemlerde de her iki yöne olan reaksiyon hızı eşit olduğunda dengeye ulaşılır. Kısaca Denge karşılıklı hızların eşitliğidir. Fiziksel değişmelerde de sağ ve sol taraflara olan değişmelerde hızların eşitliği söz konusudur.Kimyasal dengeleri fiziksel olanlardan ayıran özellik, değişmede maddelerin özelliklerinin kaybolarak farklı maddeleri vermesidir.Bazı reaksiyonların pratik bakımdan % 100 tamamlandığı kabul edilir.
Böyle reaksiyonlarda gösterilen yönlerde reaksiyon hızı ya çok yüksektir ya da reaktanların denge içinde önemsenmeyecek miktarlarda kalması söz konusudur. Bu yüzden bu tür reaksiyonlar pratik bakımdan tek yönlü (irreversible=geri dönüşümü olmayan) olarak düşünülürler.
Ancak gerçekte doğal ortamlarda veya laboratuvarlarda gerçekleştirilen bütün fiziksel ve kimyasal reaksiyonlar çift yönlüdür (reversible). Hepsinin çift yönlü ok ile gösterilmesi daha doğrudur.
Kırmızı vanayı açarak dengeyi sağlayınız.
10.3.1 Denge Sabiti ve Kütlelerin Etkimesi Kanunu
Bir kimyasal dengede, örneğin;
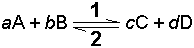
dengesi için, sağ tarafa olan 1. Hız;
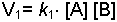
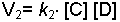
eşitlikleri ile ifade edilir. k - hız sabitidir. Ek bilgi için tıklayınız.
Denge halinde; 1. hız (sağ tarafa olan hız) 2. hıza (sol tarafa olan hız) eşit olduğuna göre;

olacaktır. k1 ve k2 reaksiyon hız sabitleridir ve birbirlerine oranı;
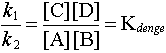
eşitliğini verir. Denge sabitini veren matematik eşitlik,
"bir kimyasal reaksiyonun ikinci tarafındaki maddelerin konsantrasyonlarının birinci tarafındaki maddelerin konsantrasyonlarına oranı sabittir" şeklinde açıklanır.
Eşitlikte [ ] mol/l cinsinden konsantrasyonu göstermektedir. Konsantrasyonlara göre yazılan denge sabiti görünen denge sabiti (yada zahiri denge sabiti) olarak adlandırılır ve Kc ile gösterilir. Gerçek denge sabiti ise aktivitelere göre yazılandır.
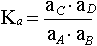
K denge sabiti birçok halde sadece temperatüre bağlıdır.
10.3.2 Gaz Fazında Denge
Gaz fazındaki;
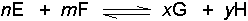
reaksiyonunu göz önüne alalım. Herhangi bir sıcaklıkta bir gazın kısmi basıncı konsantrasyonu ile doğru orantılı olduğu için bu reaksiyonun denge sabitini kısmi basınçlar cinsinden yazabiliriz.
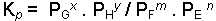
Kp kısmi basınçlar cinsinden denge sabitidir. Kısmi basınçlar genelde atm cinsinden gösterilir. Gazlarda;
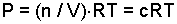
olduğundan konsantrasyon ile kısmi basınç arasında,

ilişkisi vardır. c mol/l cinsinden konsantrasyondur ve Kp denkleminde yerine konursa;
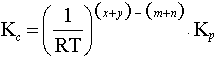
yazılır. Reaksiyondaki mol sayısı değişimi
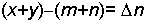
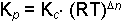
sonuç eşitliği elde edilir. Bu eşitlik gazların ideal hale yakın olduğu şartlarda geçerli olabilir. Çünkü türetme PV = nRT ideal gazların hal denklemi esas alınarak yapılmıştır.
Kuru buz sıcaklığında N2O4 katı şeklinde bulunur
Oda sıcaklığında N2O4 erimeye başlar ve NO2 konsantrasyonu ile denge ortamı oluşturur.
10.4 Çözeltilerde Kimyasal Denge
Çözeltilerdeki dengelerde konsantrasyon göz önüne alınır. Örneğin asetik asidin ve suyun denge reaksiyonları;
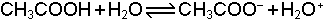
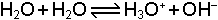
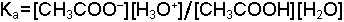
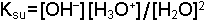
şeklindedir. Denge sabitleri ise;
olarak yazılır Ka asit sabiti, Ksu ise suyun iyonik çarpımı veya autoprotoliz sabitidir. Dengedeki H2O miktarı ideal seyreltik bir çözelti takdirinde diğer bileşenlerden çok daha yüksek konsantrasyonda olduğu için [H2O] değerinin değişmesi sınırlı kalacaktır. Yeteri kadar seyreltik çözeltilerde [H2O] sabit bir değer olarak düşünülür ve dengeyi etkilemediği varsayılır. Bu durumda Ka ve Ksu sabitleri için;
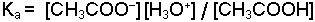
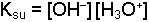
Denge halindeki Ni[(H2O)]62+ ve NiCl42- çözeltileri.
Genel Kİmya konlarI



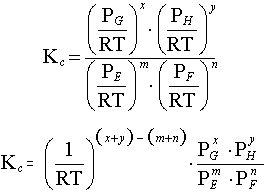
 Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
























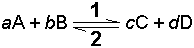
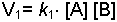
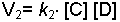

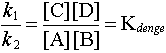
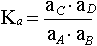
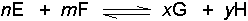
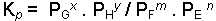
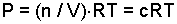

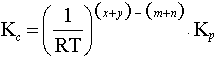
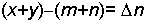
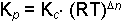
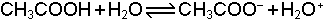
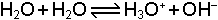
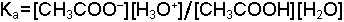
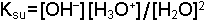
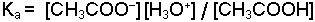
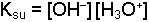 Genel Kİmya konlarI
Genel Kİmya konlarI



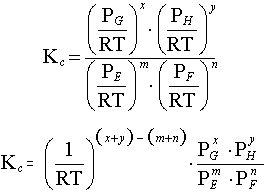
 Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri


