













Tel:
Fax:
Email:

www.hayatiboskut.com.tr






10.5 Heterojen Dengeler
Birden fazla genellikle, 2 fazlı heterojen sistemlerde söz konusudur. Örneğin CaCO3'ın termik bozunması;

denklemine göre olur. Kütlelerin etkimesi kanunu uygulandığında;
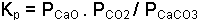
yazılır. CaCO3 ve CaO'ın kısmi basınçları hemen her sıcaklıkta sabittir ve denge sabiti üzerinde bir değişken olarak etkili değildir. Buna göre denge sabiti;
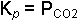
yazılır. O halde herhangi bir sıcaklıkta denge sabiti sadece karbondioksidin kısmi basıncı ile orantılıdır. Diğer bir örnek kristal suyu bulunduran tuzların dehidratasyonudur.
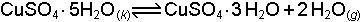
böyle bir reaksiyonun denge sabiti;

şeklinde yazılır. Çünkü dengedeki penta ve trihidrat tuzları katı fazda olduklarından kısmi basınçları sabit değer alır ve dinamik dengeye etkileri söz konusu değildir.
10.6 Dengeyi Etkileyen Faktörler
Denge halinde bulunan bir reversible reaksiyon, dışardan bir etki olmadıkça, konumunu korur. Dengeye yapılacak etki, ya denge sistemine ısı verilmesi veya ondan ısı alınması veya dengedeki maddelerin konsantrasyon değişmesi veya basıncın değişmesi şeklinde olabilir. Bu etkilerin herhangi biri söz konusu olursa dengedeki sistemin nasıl hareket edeceği Le Chatelier ilkesi sayesinde tahmin edilebilir. Bu ilke dengedeki bir sisteme bir etki yapılınca, sistemin bu değişikliğin etkisini azaltacak yönde geliştiğini ifade eder.
Dengedeki bir sisteme katalizörün etkisi yoktur. Daha doğrusu katalizörün etkisi sadece dengeye çabuk ulaşılmasını sağlamaktan ibarettir. Denge konumu ise katalizör tarafından değiştirilemez. Örneğin etil alkol ve asetik asit sisteminin denge sabiti 4,0'tür. Bu dengeye bir katalizörün yardımıyla çabuk ulaşılabilir, fakat katalizör denge sabitinin değerini 5,0 veya 3,0 yapamaz.
10.6.1 Sıcaklığın Dengeye Etkisi
Kimyasal değişmeler ekzotermik veya endotermik reaksiyonlardır. Örneğin:

reaksiyonunda amonyak meydana gelirken mol ürün başına 21,9 kcal kadar ısı açığa çıkar. Reaksiyon ekzotermiktir ve reaksiyon ısısı
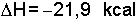
şeklinde gösterilir.
Denge halinde bu reaksiyon sistemi soğutulacak olursa denge öyle bozulur ki sonunda daha çok amonyak meydana gelir. Çünkü amonyak meydana gelmesi ısı verdiği için, Le Chatelier ilkesine göre bu ısı soğutmaya karşı koyar ve onun etkisini azaltmaya çalışır. Aynı şekilde dengedeki azot, hidrojen ve amonyaktan ibaret bu karışım ısıtılırsa, bu defa amonyak hidrojen ve azot vermek üzere bozunur. Reaksiyon endoterm olan sol tarafa doğru gelişir. Isının bir denge bileşeni gibi rol aldığına dikkat ediniz
10.6.2 Konsantrasyonun Dengeye Etkisi
Amonyak meydana gelmesi reaksiyonunu düşünelim. Eğer azot veya hidrojen konsantrasyonu arttırılırsa denge sağa kayar çünkü böylece ilave edilen maddelerin harcanması mümkün olur veLe Chatelier ilkesine göre azot veya hidrojenin konsantrasyonunun artması önlenir. Aynı şekilde dengedeki sisteme biraz amonyak ilave edersek reaksiyon sola doğru gider ve ilave edilen amonyak miktarı harcanarak artıştan kaynaklanan etki azaltılır.
Amonyak sentezi örneğinde basıncın etkisi şöyle açıklanabilir:
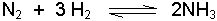
Reaksiyonu görüldüğü gibi 1 hacim azot ve 3 hacim hidrojen gazı birleşerek sadece 2 hacim amonyak gazı vermektedir. Sağa doğru olan reaksiyonda bir hacim küçülmesi olmaktadır. Eğer dengedeki sistemin basıncı arttırılırsa reaksiyon sağa doğru oluşur ve daha fazla amonyak meydana gelir. Bu da hacmin küçülmesine sebep olduğundan Le Chatelier ilkesine göre basıncın etkisi azaltılmış olur.
Eğer reaksiyon,
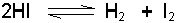
dengesinde olduğu gibi mol sayısı değişimi olmuyorsa
denklemine göre n=0 basıncın denge sabitine etkisi söz konusu olmayacaktır.
Bölüm Özeti
Bu bölümde;
- Kimyasal ve fiziksel değişmelerin denge niteliği,
- Kimyasal rekasiyonların türleri,
- Kimyasal dengenin denge sabiti ile karakterizasyonu,
- Kimyasal dengeyi etkileyen faktörler
anlatıldı.
 Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri