Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















Kimyasal Termodinamik
Termodinamik çeşitli enerji türleri arasındaki ilişkileri inceleyen bilim dalıdır. Kısaca söylemek gerekirse; termodinamik her türlü değişmedeki enerji değişimlerini inceler. Bu konuda; genel termodinamik yasalar ve bu yasaların kimyasal değişimlere nasıl uygulanabileceğinden genel olarak bahsedilecektir.
Bölüm Hedefi
Bu bölümü tamamladığınızda;
- Termodinamik yasaları,
- Termodinamiğin temel kavramlarını,
- Kimyasal termodinamiği,
- Serbest enerji denge sabiti ilişkisini
öğrenmiş olacaksınız.
11.1 Enerji
11.2 Termodinamik Kavramlar
Bu bölüm altında şu alt başlıkları inceleyeceksiniz.
- İç enerji
- Entalpi
- Serbest Enerji
Entropi
11.2.1 İç enerji
Enerji iş yapabilme gücüdür. Örneğin, kimyasal maddelerin bir kimyasal potansiyel enerjisi vardır ve bu enerji atom veya moleküllerin diziliş şekillerinden ileri gelir. Mevcut diziliş şekli değiştirilerek söz konusu potansiyel bir enerji açığa çıkarılabilir ve işe veya ısıya dönüştürülebilir (Örnek: H2SO4'ün seyreltilmesinde ısı açığa çıkar). Bir sistemin sıcaklığına, hacmine, basıncına, fiziksel ve kimyasal bileşimine bağlı olmak üzere sahip olduğu enerjiye iç enerji denir ve E ile gösterilir.
Termodinamik, özellikle iç enerjinin sıcaklık, hacim, basınç ve kimyasal ve fiziksel bileşimlerin değişmesi ile nasıl değiştiği ile ilgilenir. İç enerjinin değişmesi bir sisteme ısı (Q) veya iş (W) verilmesi ya da alınmasıyla mümkün olur. Birinci haldeki iç enerji E1 olan sisteme Q kadar ısı verildiğinde sistem W işini yaparak iç enerjisi E2 olan 2. hale geçmişse iç enerji değişmesi,
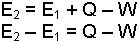
veya

yazılır.
Su üzerine derişik sülfat çözeltisi eklenirse sıcaklık yükselir.
Unutmayınız: asit üzerine su dökmek tehlikeli bir işlemdir. Aşırı ısınma ile sıcak asidin sıçraması ile üzücü kazalar meydana gelebilir.
11.2.2 Entalpi
Sabit basınçta oluşan bir değişmede hacim artışı varsa ve başka bir iş yapılmıyorsa sistemin aldığı ısı, sistemin iç enerji artışı ile hacim artışı için kullanılan ısının toplamına eşittir. Sistemin aldığı bu ısıya entalpi denir ve H ile gösterilir. Sabit basınçta sistemin entalpi değişmesi alınan ya da verilen ısıya eşittir.
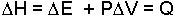
Entalpi değişmenin türüne göre; oluşum entalpisi, yanma entalpisi gibi adlar alabilir.
Oluşum Entalpisi
Her kimyasal bileşiğin standart oluşum entalpileri vardır. Örneğin, Fe2O3 için 25oC'de

değeri söz konusudur. Bu 1 mol Fe2O3'ün elementlerinden oluşurken açığa çıkan ısıdır. Ayrıca bir reaksiyonun entalpisi bileşiklerin oluşum entalpilerinden gidilerek hesaplanabilir.

Reaksiyonun entalpisini hesaplanmıştır.
Elementlerin oluşum entalpileri sıfırdır.
Yanma Entalpisi
Bir maddenin oksijenle tamamen yanmasında (oksitlenmesinde) ortaya çıkan ısıdır. Örneğin grafitin yanma entalpisi -
11.2.3 Serbest Enerji
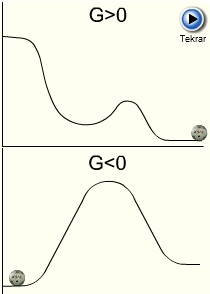
Serbest Entalpi veya Gibbs Enerjisi olarak da bilinir. Bir kimyasal reaksiyonun kendiliğinden oluşup oluşmaması hakkında karar verebilmeye yarayan termodinamik fonksiyondur ve G ile gösterilir. Serbest enerji, entalpi ve entropi ile aşağıdaki denklemde de görülebileceği gibi ilişkilidir.
G<0 ise kimyasal reaksiyon kendiliğinden olur.
G>0 ise değişme kendiliğinden olmaz, dışarıdan sisteme enerji vermek gerekir.
G=0 olduğunda ise sistem dengededir.
Standart serbest entalpiler G0 ile gösterilir ve tablolarda genellikle 1 atm ve 25oC'deki cal/mol cinsinden değerler verilir.
Bir reaksiyonun standart serbest entalpi değişmesi, entalpi değişmesinde olduğu gibi hesaplanır.
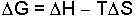
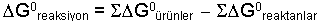
Serbest entalpi değeri bir kimyasal reaksiyonun kendiliğinden oluşup oluşmaması hakkında karar verebilmeye yarar.
Makro evrende gelişen her hareket, değişime ya da dönüşmenin bir enerji boyutu vardır. Özetle; hareket enerjidir diyebiliriz. Hatta statik sistemlerin bile bir enerji değeri (yüksekte duran bir cismin potansiyel enerjisi gibi) olduğuna göre, varoluşun temelinin enerji olması fiziksel gerçekliğin bir ifadesi olmalıdır.
Termodinamik çeşitli enerji türleri arasındaki ilişkileri inceleyen bilim dalıdır. Hemen her tür enerji ısı enerjisine çevrilebilmekte, ancak ısı enerjisini her zaman işe dönüştürmek mümkün olmamaktadır. Bunun yanında ısı da dâhil olmak üzere hiçbir enerji çeşidi %100 verimle işe dönüştürülmez. Bunlara benzer enerji tik ilişkiler, sistemlerin enerji alışverişleri, enerjilerin davranış ve dönüşümleri termodinamiğin üç yasası ile belirlenmiştir;
1. Yasa: Bir kapalı sistemde bütün enerjilerin toplamı sabittir. Enerji bir türden başka bir türe dönüşebilir, fakat yok edilemez veya yoktan varedilmez. (Enerjinin korunumu ilkesi)
2.Yasa: Termodinamiüin bu yasası enerjinin türlü şekillere dönüştürülmesini sınırlar, özellikle çeşitli enerjilerin işe çevrilmesindeki sınırları belirler.
a-
b-
c-
3. Yasa: Entropi harektliliğin (hareket miktarının) bir ölçüsüdür. Mutlak sıfır noktası (00 K) de atomik titreşimler ve elektron hareketleri, dahil olmak üzere bütün maddesel hareketlerin durduğu kabul edilir. Bu noktadan yukarı gidildikçe sırası ile elektronik hareketler, titreşimler ve öteleme hareketleri başlar, kısaca hareketlilik artar. Bu Entropi artışı olarak tanımlanır.

Bölüm -