

















11.2.4 Entropi
Mutlak sıfır noktasında (-273.16oC) bütün maddelerdeki atomik hareketler durduğu için düzenlilik maksimumdur. Sıcaklık arttıkça atomik hareketler (titreşim, dönme, öteleme) ve buna bağlı olarak entropi de artar. Entropi hareketliliğin artmasıdır ve bazı hallerde düzensizlik anlamında da kullanılmaktadır. Ancak bu düzensizlik kaotik bir kavram olarak algılanmamalıdır. ENTROPİ KARGAŞA YA DA KAOS DEĞİLDİR Bir reaksiyonun entropisi entalpi değişiminde olduğu gibi hesaplanır:

Sıcaklığı değiştirerek taneciklerin hızı artar.
11.3 Termokimya
Kimyasal reaksiyonlarda meydana gelen ısı alışverişi ile ilgili kimyasal ve fiziksel nitelik ve nicelikler termokimyanın konusudur. Termokimyanın iki temel prensibi vardır:
1-) Bir reaksiyonda açığa çıkan ısı, ters reaksiyonda alınan ısı miktarına eşittir.
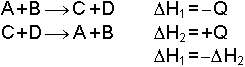
2-) Sabit basınçta bir reaksiyonun ısısı, reaksiyonun hangi yoldan gittiğine bağlı değildir. Reaksiyon ısısı H yalnız ilk ve son hallere bağlıdır. Bu ifade Hess Yasası olarak bilinir. CO2 elde etmek için;
11.4 Kimyasal Reaksiyonlardaki Serbest Entalpi Değişimi
Bir maddenin serbest entalpisine kimyasal potansiyel adı da verilir. Genel olarak
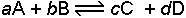
reaksiyonu için serbest enerji değişimini veren eşitlik;

şeklindedir. Sistem denge halinde ise
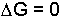
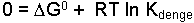
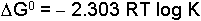
yazılabilir. Bu eşitlik, denge özellikleri ile termodinamik fonksiyonlar arasındaki ilişkiyi ortaya koyar. Denge sabiti için,
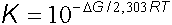

eşitliği göz önüne alınırsa,
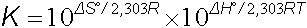
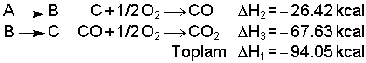

Kimyasal reaksiyonda gidilen yol değil varılan nokta önemlidir.
Bölüm Özeti
Bu bölümde;
- Termodinamiğin temel yasaları,
- İç enerji, entalpi ve serbest enerjinin kimyasal değişmelerdeki yeri ve önemi,
- Hess yasası ve kimyasal reaksiyonlar,
- Kimyasal dengelerin enerji boyutu
incelendi.
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri






Termodinamiğin Temel Yasaları


























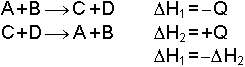
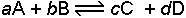

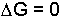
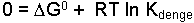
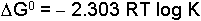
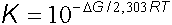

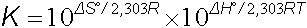
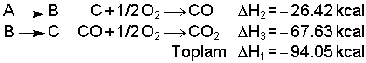
 Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri