Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















Kimyasal Kinetik
Kimyasal reaksiyonlarda denge hali termodinamik ilkelerle belirlenir. Denge haline ulaşma zamanı ve buna bağlı olarak reaksiyon hızları da kimyasal kinetiğin konusudur. Reaksiyon kinetiği, reaksiyonların hızını ve hızın bağlı olduğu faktörleri inceler.
Kimyasal Kinetik konusu içinde kimyasal reaksiyonların nasıl oluştuğu, oluşma hızları ve oluşma hızlarının nasıl değişebileceği incelenecektir.
Bölüm Hedefi
Bu bölümü tamamladığınızda;
- Reaksiyonların oluşum makenzimasını,
- Reaksiyonların oluşumları ile ilgili teorileri,
- Aktivasyon enerjisi -
hız ilişkisini, - Katalizörler ve etki makenizmalarını,
- Homojen ve heterojen katalizörler,
öğrenmiş olacaksınız.
12.1 Reaksiyonların Hızları
Reaksiyon hızı birim zamanda birim hacimde dönüşüme uğrayan maddelerin mol sayısına bağlıdır. Kinetik bakımdan kimyasal reaksiyonlar hızlarına göre ölçülebilir ve ölçülemeyen olmak üzere ikiye ayrılır.
Bazı reaksiyonlar o kadar hızlı olur ki bunların hızlarını ölçmek pratik bakımdan mümkün olmaz. Örneğin F2 ve H2 gazları bir kıvılcım yardımıyla ani olarak reaksiyona girerek bir patlama ile HF verir. H2SO4 ve NaOH gibi kuvvetli bir asit ile kuvvetli bir baz karıştırılırsa çok kısa zamanda bir nötralizasyon reaksiyonu olur. Bu reaksiyonların hızını ölçmek pek mümkün değildir. Diğer bazı reaksiyonlarda ise hız son derece küçüktür, zamanla dönüşme pek yavaş olacağı için bunların hızı da pratikte ölçülemez. Örneğin; bir kapta beraber bulunan O2 ve H2 gazları yıllarca beklense de reaksiyon içine girmez veya reaksiyon o kadar yavaştır ki, ne harcanan gaz miktarını ne de meydana gelen su miktarını ölçmek mümkün değildir.
Bazı anorganik ve organik reaksiyonlar ise normal bir hızla olurlar ve bu hızın ölçülmesi mümkündür. Böyle reaksiyonlar genel olarak tam olurlar, yani reaksiyona katılan madde veya maddeler tamamen harcanır. Ancak reversibl reaksiyonların hızı da ölçülebilir.
Kimyasal Kinetik, ölçülebilir hızlarda gerçekleşen reaksiyonları konu alır
12.2 Reaksiyon Mekanizması
Reaksiyonlar çoğu zaman, stokiometrik denklemde gösterildiği gibi oluşmazlar. Esasında stokiometrik denklem, reaksiyona giren türleri ve miktarlarını belirtirken, reaksiyonun oluş biçimi hakkında bilgi veremez. Daha önce belirtildiği gibi, bir reaksiyonun olabilmesi için taneciklerin çarpışması gerekir. Örneğin
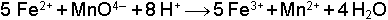
reaksiyonu asidik çözeltide çok çabuk oluşan bir reaksiyondur. Bu reaksiyonun birinci tarafında on dört iyon reaksiyona girmektedir. Bütün bu iyonların bir anda reaksiyona girdiği düşünülecek olursa, bu iyonların aynı anda birbiriyle çarpışmaları gerekir ki bu, birçok sebepten dolayı imkânsız gibidir. Öyleyse reaksiyonun bir defada değil, ard arda birçok adımda oluştuğunu ve bu adımların da kolayca gerçekleşecek çarpışmalara bağlı olduğunu düşünmeliyiz. O halde karmaşık bir reaksiyonun daha basit adımlar ile meydana geldiğini düşünmek gerekir. Bu reaksiyon adımları topluluğuna Reaksiyon Mekanizması adı verilmektedir. Bir reaksiyonun mekanizmasındaki en yavaş yürüyen reaksiyon, reaksiyon hızını belirley
12.3 Reaksiyon Derecesi
Bir kimyasal reaksiyonda derece, hızın dönüşen madde konsantrasyonuna bağlı olduğu dereceye eşittir. Örneğin;

radyoaktif bozunmasında, reaksiyon hızı Ra atomlarının sayısı ile doğrudan orantılıdır.
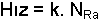
olmalıdır. Eşitlikte, k hız sabitidir.
reaksiyonunda ise derece 2 olarak bulunur. Çünkü hız HI konsantrasyonunun karesi ile orantılıdır.
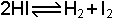
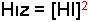
Reaksiyon hızları denklemlere bakılarak tayin edilmez. Bahsedilen örneklerde dereceler denel olarak bulunmuştur.
12.4 Yarılanma Süresi
Bir reaksiyonda, dönüşen madde konsantrasyonunun yarıya inmesi için geçen zamana Yarılanma Süresi denir. Yani reaksiyonun başlangıcında madde konsantrasyonu Co ise ve yarım saat sonra bu konsantrasyon Co/2 değerine düşüyorsa, o reaksiyonun yarılanma süresi yarım saat demektir. Yarılanma süresi genellikle t1/2 ile gösterilir.
12.5 Reaksiyon Hız Teorileri
Reaksiyon kinetiğinin temel amaçlarından birisi, reaksiyonda yer alan maddelerin bazı özelliklerinden faydalanmak suretiyle reaksiyon hızını önceden bildirecek bir teorinin geliştirilmesidir. Bu konuda ortaya konan iki teori Çarpışma Teorisi ve Mutlak Hız Teorisi'dir. Bunlardan ikincisi Aktiflenmiş Kompleks Teorisi olarak da adlandırılır.
12.5.1 Çarpışma Teorisi
Kimyasal kinetiğin birçok problemi çarpışma teorisi ile açıklanmıştır. Bu teori klasik kinetik, statik mekanik ve termodinamiğe dayanmaktadır. Çarpışma teorisine göre, bir kimyasal reaksiyonun olması için, reaksiyona giren maddelerin en küçük taneciklerinin (molekül, atom veya iyon) birbirleri ile çarpışması gereklidir. Çarpışma esnasında moleküllerde bulunan atomlar veya atomlarda bulunan elektronlar yeniden düzenlenir. Kimyasal bağların yeniden değişmesi gerçekleşir ve bunların sonucu yeni bir bileşik oluşur.
Arrhenius tarafından 1889 da ileri sürülen,
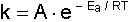
k hız sabitini veren eşitlikteki A Arrhenius frekans faktörünün anlamı uzun zaman anlaşılamamıştır. Bu sabite ait ilk açıklama 1918 yılında G. N. Lewis tarafından yapılmıştır. Buna göre A faktörü moleküller arasındaki çarpışmanın çokluğuna bağlıdır. Bu çarpışmalar ile ilgili olarak A yerine Z faktörü konularak, yukarıdaki formül,
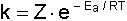
şeklinde elde edilmiş olur. Burada Z çarpışan taneciklerin sayısı ile ilgili bir faktördür.
Kimyasal kinetiğin birçok problemi çarpışma teorisi ile açıklanmıştır
12.5.2 Mutlak Hız Teorisi
Çarpışma teorisindeki gelişmeler bazı kompleks reaksiyonları açıklamaya yeterli olmamıştır. Bunun için 1935 yılında Amerikalı kinetikçi H. Eyring tarafından çarpışma teorisinde bazı değişiklikler yapılarak Mutlak Hız Teorisi ortaya atılmıştır. Bu teori kuantum teorisi ve dalga mekaniğine dayanır.
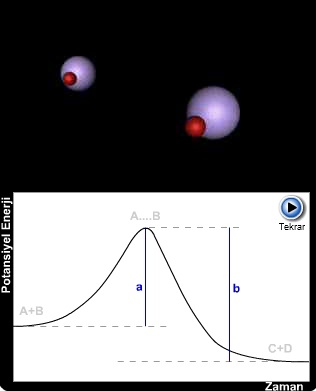
Açıklama için; A ve B taneciklerinin çarpışarak C ve D ürün taneciklerini oluşturmasına ait bir reaksiyon göz önüne alınabilir. Burada, önce A ve B tanecikleri birbirine çarparak geçici bir ara ürün olan AB taneciğini oluştururlar. Aktifleşmiş kompleks denilen bu AB ara ürünü A ve B reaktanlarını tekrar meydana getirmek üzere ayrışabileceği gibi, bir başka yolla C ve D gibi yeni ürünler vermek üzere de ayrışabilir.
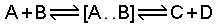
Mutlak hız teorisi, A ve B moleküllerinin aktifleşmiş kompleks vermek üzere bir araya gelmesi ve C ve D gibi yeni iki moleküle ayrılması sırasında, sistemin potansiyel enerjilerinde meydana gelen değişmeler yardımıyla reaksiyon hızını hesaplamaktadır.
Moleküllerin potansiyel enerjileri düşey eksende ve reaksiyonun zamana göre ilerleyişi yatay eksene alınmak suretiyle çizilen basit bir reaksiyon potansiyel enerji değişimi görülmektedir.
A ve B tanecikleri birbiri ile etkileşerek geçici bir ara ürün olan A...B ünitesini oluştururlar.
12.5.2.1 Aktivasyon Enerjisi ve Aktifleşmiş Kompleks
Eğer taneciklerin kinetik enerjileri yeter derecede değilse, aktifleşmiş kompleksin oluşumu için gerekli potansiyel enerjiye ulaşılamayacağından reaksiyon meydana gelmez.
Yüksek sıcaklıklarda moleküllerin kinetik enerjileri (Bölüm 9 daki Kinetik Teoriyi tekrar inceleyiniz) artacağından aktif kompleks oluşumu için gerekli aktivasyon enerjisi (Ea) değerine kolayca ulaşılabilir.A ve B'nin başlangıç halinin toplam potansiyel enerjisi ile aktifleşmiş kompleksin potansiyel enerjisi arasındaki (a) ile gösterilen fark reaktan moleküllerini reaksiyona sokmak için verilmesi gereken enerji miktarını belirlemektedir ve bu ileri doğru olan reaksiyonun
aktivasyon enerjisidir.
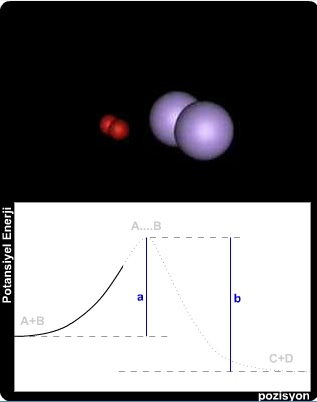
Diğer taraftan, grafiğe tersten bakılacak olursa,
reaksiyonunun potansiyel enerji değişimi ortaya çıkar. Bu durumda, C ve D'nin toplam potansiyel enerji toplamı ile aktifleşmiş kompleksin potansiyel enerjisi arasındaki (b) farkı geri reaksiyonun aktivasyon enerjisi olmaktadır.
Buna göre; (a) değeri (b)'den ne kadar büyük ise reaksiyon sağ tarafa doğru o kadar hızlı olacaktır. (a) ile (b)'nin eşit olması hali; reaksiyonda dengeye ulaşıldığını gösterir; çünkü her iki yöne olan reaksiyon hızları eşit olmuştur.
Reaksiyon herhangi bir şekilde katalizlenmiş ise, potansiyel enerji eğrisinde bir alçalma görülür. Bu durumda, taneciklerin reaksiyona girmeleri için gerekli aktivasyon enerjisi azalmış olur. Sonuçta, birim zamanda bu enerji değerine ulaşan çarpışma sayısı artacağından reaksiyon o oranda hızlanacaktır.
Potansiyel enerji -

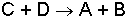

Bölüm -



1
2
3