




Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















12.6 Reaksiyon Hızına Etki Eden Değişkenler
Bu bölüm altında şu alt başlıkları inceleyeceksiniz.
- Sıcaklık Etkisi
- Konsantrasyon Etkisi
12.6.1 Sıcaklık Etkisi
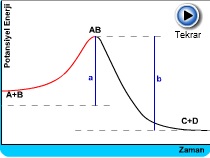
Fazla enerji kazanıp reaksiyon vermeye hazır olanlar aktif moleküllerdir. Genel olarak bu moleküllerin oranı reaksiyon hızını tayin eder. Eğer bir reaksiyonun aktivasyon enerjisi Ea büyükse, moleküllerin pek azı bu enerjiye sahip olabileceğinden reaksiyon yavaş olur. Aktivasyon enerjisi küçük ise, daha çok molekül bu değere erişebilir ve reaksiyon hızlı yürür. Aktiflenmiş moleküllerin sayısı, ortama enerji verilmesiyle arttırılabilir. Bu enerji genellikle ısı şeklinde olur. Reaksiyon veren maddeler ısıtılırsa, minimum enerjiye sahip olan moleküllerin oranı artar ve reaksiyon daha hızlı yürür.
Sıcaklığın reaksiyon hızına etkisi çok büyüktür. Birçok reaksiyonlarda sıcaklığın 10oC artması reaksiyon hızını 2-
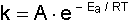
Burada k reaksiyon hız sabiti, A bir sabit, R gaz sabiti, T mutlak sıcaklık ve Ea aktivasyon enerjisidir.
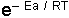
terimine Boltzmann Faktörü denir. Boltzmann faktörü, enerjisi Ea veya Ea'nin üstünde olan moleküllerin kesrini gösterir. Bir molekülün bir molekülle reaksiyon vermesi için çarpışmaları şarttır. Ayrıca bu moleküllerin bir minimum enerjiye sahip olması gerekir, bu minimum enerjiye Aktivasyon Enerjisi (Eşik Enerjisi) denir. Reaksiyon için gereken A sabiti, çarpışma sayısı veya frekans faktörü adını alır. Sıcaklığın (T) çok az değişmesi Hız sabitinin (k) değerini çok fazla değiştirir. Ek bilgi için tıklayınız.
Sıcaklık artışının potansiyel enerjiye etkisi
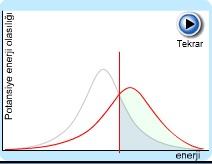
Eşik enerjisini aşan ortalama sahip olan atomların miktarı
12.6.2 Konsantrasyon Etkisi
Bir reaksiyonun olabilmesi için, ortamdaki moleküllerin bir minimum enerjiye sahip olarak çarpışmaları gerektiğini gördük. Gaz veya sıvı fazlarda bulunan moleküllerin ortalama enerjisi sıcaklığa bağlıdır.
Sabit bir sıcaklıkta ise aktiflenmiş moleküllerin sayısını, dolayısı ile reaksiyon hızını arttırmanın bir diğer yolu; reaktanların konsantrasyonlarını arttırmaktır. Belli bir sıcaklıkta bütün moleküllerin sabit bir oranı Ea enerjisine sahip olacağından, konsantrasyonu arttırmakla aktivasyon enerjisine ulaşan moleküllerin oranı değişmez. Ancak; Ea enerjisine sahip moleküllerin mutlak sayısı artacağından reaksiyon hızında bir miktar artma görülür.
12.7 Katalizörler
Bir reaksiyonun hızını arttırmanın ön önemli yolu aktivasyon enerjisini azaltmaktır. Çünkü bu halde, belli bir sıcaklıkta, moleküllerin daha büyük bir kesri, az olan bu aktivasyon enerjisine sahip olabilecektir. Ancak; herhangi bir
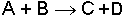
reaksiyonu için Aktivasyon enerjisi değeri o sistemin karakteristiğidir ve sabittir.
"Reaksiyonun aktivasyon enerjisini düşürmek" deyimi bu bakımdan gerçeği ifade etmez.
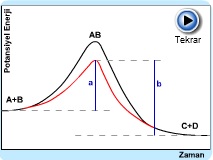
Doğru olan; bu reaksiyon ile elde edilmek istenen C bileşiğine daha düşük aktivasyon enerjili reaksiyon mekanizması ile ulaşmaktır. İşte bu şekilde, daha küçük aktivasyon enerjili reaksiyonların (ara basamaklar) oluşmasını sağlayarak reaksiyonun hızını değiştiren maddelere Katalizör denir.
Katalizör bir reaksiyonu başlatmaz, ancak yavaş gitmekte olan bir reaksiyonun hızını değiştirir. Bu arada, kendisi değişmeden reaksiyon sonunda ele geçer. Katalizör bir denge reaksiyonunda dengenin konumunu değiştirmez yani denge sabitinin değerine etki edemez. Fakat hem sağa hem de sola giden reaksiyonun hızını arttırarak dengenin çabuk kurulmasını sağlar.
Katalizörlü ve katalizörsüz reaksiyonların aktivasyon enerjileri.
Kırmızı çizgi katalizör sayesinde oluşan farklı mekanizmaya sahip reaksiyonu göstermektedir.
12.7.1 Katalizörlerin Etki Mekanizması
Bir katalizörün etkisi; aktivasyon enerjisi yüksek mekanizma yerine aktivasyon enerjisi düşük yeni bir mekanizmayı ortaya koymakla gerçekleşir.
Genel olarak bu etki şöyle olur: Katalizör, ortamdaki bir madde ile reaksiyona girerek bir ara ürün meydana getirir; sonra bu ara ürün ya kendiliğinden parçalanarak veya başka bir madde ile reaksiyona girerek ürünleri verir. Bir reaksiyon yerine birkaç reaksiyon olmakta ve reaksiyon birkaç adım üzerinden yürümektedir. Bu ara reaksiyonların aktivasyon enerjileri ana reaksiyonunkinden daha küçük ise reaksiyon hazırlanmış olmaktadır.
Örneğin;
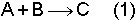
reaksiyonunun aktivasyon enerjisi yüksek olsun. Yani bu reaksiyon normal olarak yavaş yürür. K ile göstereceğimiz homojen katalizör ilave edilince, aktivasyon enerjisi düşük bir ara basamak ile önce;
reaksiyonu meydana gelir. Sonra yine aktivasyon enerjisi (1) reaksiyonundan düşük olan
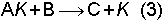
gibi bir reaksiyon olur. (2) ve (3) reaksiyonlarının toplamı (1) reaksiyonunu vereceğinden elde dilen sonuç C ürünün daha hızlı oluşması olacaktır.
12.7.2 Homojen ve Heterojen Kataliz
Reaksiyona giren maddelerle katalizör bir tek faz oluşturuyorsa buna homojen kataliz denir. Daha önce sözü edilen etilasetatın hidrojen iyonları ile hidrolizi reaksiyonu homojen kataliz için iyi bir örnektir. Kurşun odalar yöntemi ile sülfürik asit yapılmasında NO2 gazı buna benzer bir katalizör rolü oynar:
1. ara basamak:
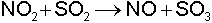
2. ara basamak:

toplam reaksiyon:

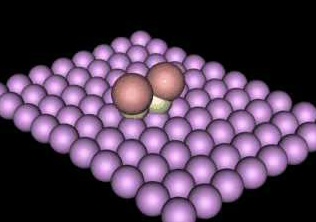
Katalizör, reaksiyona giren maddeden başka bir faz teşkil ediyorsa bu tip katalize Heterojen kataliz denir. SO2 ve O2 gazlarının birleşmesi katalizlenmektedir. Platin katı olup diğer maddeler gaz fazında olduklarından reaksiyon heterojen ortamda olmaktadır. Heterojen katalizin mekanizması şöyledir: Katalizör, maddeleri kendi yüzeyinde absorbe eder. Katalizörün yüzeyi ile absorbe edilen maddenin bir kısmı arasında büyük çekim kuvvetleri varsa, madde molekülünün başka bir kısmındaki bağları gevşetebilir. Böylece maddenin reaksiyon vermek için aktivasyon enerjisi azalır ve dolayısıyla reaksiyon hızı artar. SO2'den SO3 eldesi Platinin heterojen katalizör olarak kullanılması ile yapılabilir. Burada [PtO2]* aktif kompleksi meydana gelir.
Oksijen molekülleri bağları vasıtası ile Platin yüzeyinde adsorbe olurlar. Bu; bir fiziksel adsorbsiyondur. Bu şekilde, moleküldeki oksijen atomlarını bir arada tutan bağlar gevşer ve kolayca atomal (radikal) oksijen elde edilebilir. Sonuçta SO2 +O2 reaksiyonu için gereken aktivasyon enerjisi düşük ara basamak elde edilmiş olunur. Heterojen katalize örnek verilen toplam reaksiyon ek bilgideki gibi gösterilebilir. Birçok biyokimyasal değişme Enzim denilen bazı organik katalizörler sayesinde düzenlenir. Enzimler birer protein olup heterojen katalizör olarak iş görürler.
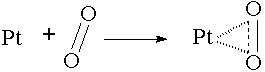
Canlandırmada mavi-
Katalizör hiç değişmeden reaksiyon zincirini tamamlar.
Bölüm Özeti
Bu bölümde;
- Reaksiyon mekanizması ve derecesi,
- Çarpışma ve mutlak hız teorileri,
- Aktivasyon enerjisi ve hız sabiti,
- Reaksiyon hızına sıcaklık etkisi,
- Katalizörlerin etki mekanizmaları
incelendi.



1
2
3

1
2


