Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















9.2.4 Kriyoskopi
Çözeltilerin donma noktaları saf çözücülerden daha düşüktür. Elektrolit olmayan seyreltik bir çözeltinin donma noktası alçalması çözünen maddenin konsantrasyonu ile doğru, çözünen maddenin mol tartısı ile ters orantılıdır. Mol tartısı bilinmeyen bir bileşiğin belirli tartımı, uygun bir çözücüde çözülerek donma noktasının düşmesi tespit edilir. Bu yolla mol tartısı tayinine kriyoskopi denir. Mol tartısı,
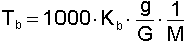
bağıntısı ile hesaplanır. Te = Donma noktası alçalması; Ke = Molal donma noktası alçalması sabitidir.
Ebülyoskopi ve Kriyoskopi metotlarının uygulanabilmesi için;
1. Çözünen maddenin iyonik olmaması,
2. Karışımın gerçek çözelti sayılabilecek homojenlikte ve ideal çözelti seyreltiklik sınırını (10-
3. Çözünen madde ile çözücü arasında kimyasal reaksiyon olmaması
gerekmektedir.
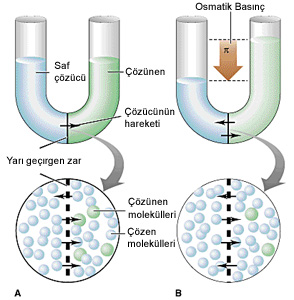
Osmatik basınç deneyi. A resmi ilk durumu, B resmi ise denge
sağlandıktan sonraki durumu göstermektedir. Sıvı yükseklikleri
arasındaki fark osmatik basınçtan dolayıdır.
9.2.5 Osmotik Basınç
Yarı geçirgen bir zarla ayrılmış çözücü ve çözeltiden ibaret bir sistemde saf çözücü moleküllerinin çözeltiye geçmesine osmoz denir. Örneğin sulu şeker çözeltisi/su sisteminde su molekülleri yarı geçirgen zardan geçer ancak şeker molekülleri geçemez. Bu şekilde çözücü moleküllerinin saf çözücüden çözeltiye doğru yarı geçirgen zardan geçişini durdurmak için çözelti tarafından uygulanan basınca osmotik basınç denir.
Yapılan araştırmalarla elde dilen denel sonuçlar Van't Hoff bağıntısında özetlenebilir.
İdeal gaz denklemine benzeyen bu eşitlik
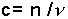
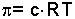
alınarak,
yazılabilir. c molar konsantrasyondur. Bu bağıntıdan şu sonuç çıkar. Seyreltik bir çözeltinin osmotik basıncı çözünmüş maddenin aynı sıcaklıkta aynı hacmi gaz halinde kapladığında sahip olacağı basınca eşittir. Van't Hoff Kanunu elektrolit olmayan ve 0,2 molardan daha az konsantrasyondaki ideal seyreltik çözeltilere uygulanabilir. Osmotik basınç ölçülmek suretiyle de mol tartısı tayini yapılabilir.
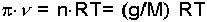
denklemindeki basıncı ölçülerek mol tartısı (M) hesap
9.2.6 Elektrolit Çözeltiler
Genel anlamda çözeltide iyonlar vererek çözünen ve sulu çözeltileri elektriği ileten bileşiklere elektrolit denir. NaCl, Al2(SO4)3, Cu(CH3COO)2 gibi iyonik yapılı bileşikler suda ve suya benzeyen çözücülerde iyonlarına ayrılarak çözünür ve bu iyonlarla elektrik iletimi olur.
Elektrolitler birçok gruplara ayrılmakla birlikte asit-
Elektrolit çözelti.
9.3 Asit ve Bazlar
Elektrolitlerin sınıflandırılmasında en kullanışlı seçim; maddelerin asit ve bazlıklarını dikkate alan yaklaşımdır. Bunun en önemli nedeni kimyasal değişmelerde asit ve bazlığın oynadığı roldür. En önemli kimyasal özelliklerden olan asit-
9.3.1 Klasik Asit-
Bileşiklerin asit ve baz karekterlerinin yapısal nedenleri günümüze kadar değişik şekillerde açıklanmaya çalışılmıştır. Bunlardan birincisi klasik asit-

Bu açıklama ile; bünyesinde OH-
9.3.2 Brönsted-
Bu tanımda asit-
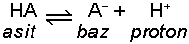
dengesi vardır ve H+ verebilen maddeler asit, H+ alabilen maddeler baz olarak değerlendirilebilir. Tanıma göre; HA bileşiği H+ iyonu verdiği için asit, A-
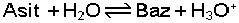
dengesi ile gösterilebilir. Bu denkleme göre H2O bir bazdır ve konjuge asidi H3O+ iyonudur. O halde bu asit-
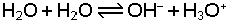
şeklinde yazılır. Dengedeki H3O+ (asit bileşen) konsantrasyonunu arttıran bileşikler asit, OH-

Yapısında H+ iyonu bulunmayan metal iyonlarının asitlikleri de bu tanımla açıklanabilmektedir. Örneğin Fe3+ iyonu sulu çözeltide H3O+ konsantrasyonunu arttırdığı için asittir.

Konjuge asit-
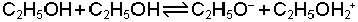
Etil alkolün autoprotoliz dengesine bağlı olarak klorür asidi ile amonyağın alkoldeki asit-
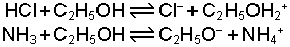
O halde Brönsted-
Ancak, çözücünün autoprotoliz dengesini temel alan bu yaklaşım aprotik çözücülerde ve gaz fazındaki asit-
9.3.3 Lewis Asit-
Lewis tanımında asit ve bazlık elektron çiftleri ile açıklanır. Elektron çifti alabilen maddeler asit, serbest elektron çifti bulunduranlar ise bazdır. Örneğin, amonyakta bir serbest elektron çifti vardır (:NH3) ve bazik özellik gösterir. Ag+ iyonu ile amonyağın reaksiyonu,
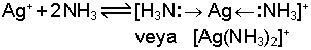
şeklindedir ve koordinasyon kovalens bağ meydana gelir. O halde burada Ag+ asit özellik taşır. Amonyak molekülündeki azot, üzerindeki elektron çiftini çekerek koordinasyon kovalens bağ meydana getirmiştir.Metal iyonları ile serbest elektron çifti içeren kimyasal yapılar arasındaki buna benzer reaksiyonlar, hem protik hem de aprotik çözücülerde (hatta gaz fazında) aynı sonuçları verecektir. Su ve Amonyak gibi autoprotoliz dengesine sahip olmayan benzen, eter, kloroform gibi çözücülerdeki baz fonksiyonu ile metal iyonlarının asidlikleri böylece açıklanabilmektedir. O halde amonyak her ortamda baz özelliğini sergileyebilmekte, ancak bazlığın açıklama şekli değişmektedir. Lewis tarafından yapılan bu açıklama ile Brönsted-
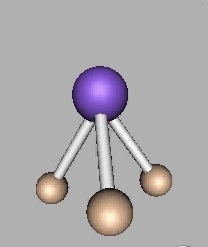
NH3
NH3 molekülü
NH3 molekülü


 Genel Kİmya konlarI Geri
Genel Kİmya konlarI Geri