


Genel kimya I-

Esasen; Brönsted-

Autoprotoliz; iki su molekülünün birbirleri ile reaksiyona girdiği kimyasal bir değişimdir. Bu değişmenin makenizması araştırıldığında; birinci su molekülü üzerindeki bağ yapmamış elektron çiftlerinden birinin diğer su molekülündeki hidrojen atomuna yaklaştığı (ya da bu hidrojen atomun söz konusu elektron çiftini kendine çektiği), sonrasında ikinci su molekülündeki H-
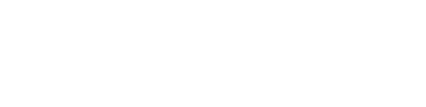
Burada birinci su molekülü bir Lewis bazı diğeri Lewis asidi gibi davranmıştır. Amonyağın su ile olan reaksiyonunda da elektron çiftleri baş roldedir.
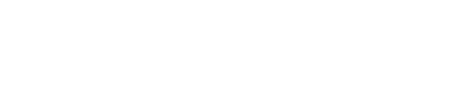
O halde elektron çiftlerinin rolüne dayanan açıklama daha temel bir yoldur. Gerçekte, tüm kimyasal reaksiyonlarda elektronların "araç" olduğu göz önüne alınırsa Lewis asit-