




Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















9.1.1.4 Kolloidlerde Sedimantasyon
Kolloid taneciklerin boyutu gerçek çözeltilerdeki atom ve moleküllere göre büyük olduğu için yer çekimi etkisiyle aşağıya doğru düşme eğilimi gösterirler.Taneciklerin difüzyon eğilimi, sedimantasyonu önleyen bir karşı kuvvettir. Difüzyon az ise, uzun zaman kendi haline bırakılan bir kolloid çözeltisinde yavaş yavaş sedimantasyon olayı görülür. Böylece çözeltinin dip tarafında kolloid taneciklerin konsantrasyonu artar (En aşağıda en ağır tanecikler toplanacağından bu olay için geliştirilmiş olan formüller sayesinde parçacıkların büyüklüğü ve kütlesi hesaplanabilir).Bazen sedimantasyon olayı özel bir alet yardımıyla hızlandırılır. Bu alet ultrasantrifüj olup dakikada 40-
Santrifüj.
9.1.1.5 Kolloidlerde Çökme
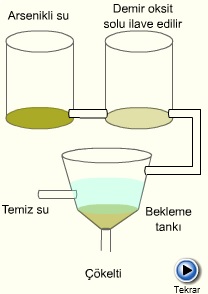
Kolloid taneciklerin çökmesini önleyen neden hepsinin aynı cins elektrikle yüklü olmalarıdır. Aynı yükler birbirini ittiğinden tanecikler bir araya gelerek çökemezler ve kolloid hal devam eder. Taneciklerin yükü ortadan kalkarsa kolloid hal bozulur ve koagülasyon denen çökme olayı meydana gelir.Örneğin pozitif yüklü demir(III)hidroksid solü bir başka kapta bulunan negatif yüklü arsenik sülfür solü üzerine ilave edilirse yükler nötralize edilir ve kolloidler çökerler.
Kolloidlerin çökmesini önlemek için kullanılan yöntemlerden biri şudur: Liyofob olan bir sol üzerine liyofil bir sol ilave edilerek onu koruması sağlanır. İlave edilen koruyucu kolloid adını alır. Negatif yüklü olan (su çeken) hidrofil kolloid, negatif yüklü hidrofob kolloidin özelliği olan ilaçların hazırlanmasında çok kullanılan bir özelliktir.Kolloidlerin koruyucu gücünü ölçmek için altın sayısı birimi kullanılır. 10 ml altın solü'ne, belli miktarda %10'luk sodium klorür ilave edilir. Bu karışımın renginin kırmızıdan maviye dönmesini önleyebilen koruyucu kolloid miktarına (miligram cinsinden) altın sayısı denir ve kolloidlerde koruyuculuk özelliğinin bir ölçüsüdür.
Çökertme, arseniği sudan ayırma işlemi sırasında da kullanılır.
9.1.1.6 Kolloidlere pH Etkisi
Amfoter olan protein maddeleri ortamda hidrojen veya hidroksil iyonları olmasına göre iyonlaşarak anyon veya katyonlar verirler. Dissosiye olmamış protein molekülü melez bir iyon çifti halindedir. Dissosiye olunca pH'ya bağlı olmak üzere anyon veya katyon verir:
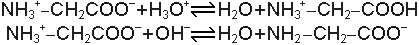
Bovine serum albumin (BSA) proteinin sabit elektrik alanda farklı pH değerlerindeki sıvınların içinden geçerken gösterdiği yoğunluk diagamları.
İzoelektrik nokta bu türden maddelerin önemli karakteristiğidir. Yani bu pH'da kolayca koagülasyona uğrayarak çökerler. Bütün amino asit ve proteinlerin kendilerine özgü izoelektrik nokta değerleri vardır. Örneğin Hemoglobin için izoelektrik nokta pH = 6.8, yumurta akı için protein pH = 4.8'dir.
9.2 Homojen Karışımlar
Fiziksel ve kimyasal bazı özelikleri bakımından benzer olan iki veya daha fazla madde birbirleriyle atomik boyutta (ölçülerde) karışarak homojen karışımları meydana getirirler. Meydana gelen bu karışımların fiziksel özellikleri bileşenlerin fiziksel özelliklerinin ortalamasıdır. Homojen karışımlar genelde çözelti olarak adlandırılır ve maddenin 3 hali göz önüne alınırsa, 9 türlü çözeltinin mümkün olabildiği görülür. Çözeltiler tek fazlı sistemlerdir ve karışım içersinde miktarca çok olan bileşene çözücü, az olana çözünen madde denir. Örneğin alkol ve suyun meydana getirdiği çözeltide su oranı fazla olduğunda, alkol suda çözünmüştür. Alkol oranı fazla ise, çözücü alkol çözünen madde sudur.
9.2.1 Çözeltilerle İlgili Kavramlar
9.2.2 Konsantrasyon
Çözeltide çözünen maddenin kantitatif (nicel) ölçüsüdür. Çeşitli konsantrasyon birimleri vardır.
* Birimlerle ilgili bilgi almak için ilgili butonu tıklayınız.
9.2.3 Raoult Kanunu ve Ebülyoskopi
Sıvı ile sıvıya ait gaz fazı arasında dinamik bir denge bulunmaktadır. Bu denge, şüphesiz sıvının yapısal özelliklerine bağlıdır. Ancak dengeyi tarif eden büyüklük (parametre) basınçtır. Saf sıvılarda olduğu gibi homojen karışımlar olan çözeltiler için de basınç (ya da buhar basıncı) çözeltiye ait fiziksel büyüklüklerle yakından ilişkilidir. Çözelti ve buhar basıncı arasındaki ilişki Raoult tarafından ortaya konmuştur. Belirli bir sıcaklıkta saf çözücünün buhar basıncı P0, çözeltinin buhar basıncı P ise (P0-
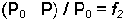
Çözünen maddenin mol kesri

olduğundan,
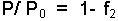
yazılabilir. Çözücü ve çözünenin mol kesirleri toplamı
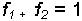
Buna göre;
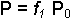
yazılır. Bu halde çözeltinin buhar basıncı çözücünün mol kesri ile orantılı olur.Bir çözeltinin buhar basıncı çözücününkinden daha küçük olduğuna göre sabit dış basınçta, çözeltinin kaynama noktası saf çözücünün kaynama noktasından daha yüksektir. Sabit basınçta elektrolit olmayan seyreltik bir çözeltinin kaynama noktasının yükselmesi; çözeltinin konsantrasyonu ile doğru çözünmüş maddenin mol tartısı ile ters orantılıdır. Bu özelliklerden yararlanılarak yapılan mol tartısı tayinine ebülyoskopi denir ve Tb = Kaynama noktası yükselmesi; Kb = çözücüye ait molal kaynama noktası yükselmesi sabiti; G = çözücünün gram miktarı; g = çözünen maddenin gram miktarı; M = çözünen maddenin mol tartısı olmak üzere aşağıdaki denklem kullanılır:
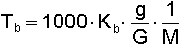
Raoult Kanunu'nun şematize edilmiş hali.

PBNO3 çözeltisine KI ilave edildiğinde PbI2 (sarı çökelti) ile su fazı hetorejen bir karışım meydana getirirken suya ilave edilen KI homojen bir karışım meydana getirir.


Bu reaksiyonların belirli iyonlaşma sabitleri olup, bu sabit sayesinde belli bir pH'da katyon ya da anyon meydana geleceği veya proteinin melez molekül halinde mi olacağı bilinebilir. Belli bir pH'da amfoter türden bu maddeler melez iyon çifti halinde kalırlar, negatif veya pozitif iyon vermezler. Dolayısıyla elektroforezde hiçbir elektroda göç etmezler. Bu pH değerine İzoelektrik nokta denir.
 Genel Kİmya konlarI
Genel Kİmya konlarI
 Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri

çözünürlük











Doymuş Çözelti











Çökme





















kristalizasyonma











Çözünürlük Çarpımı











Disasyasyon











Asosiyasyon











Solvasyon


Ağırlık Yüzdesi











Yüzde Konsantrasyon
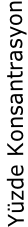











Mol Kesri
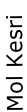




















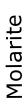
Molarite











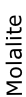
Molalite











Formalite












Normalite











Normalite
