




Tel:
Fax:
Email:

www.hayatiboskut.com.tr


















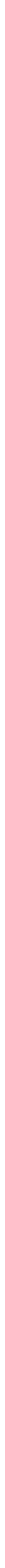



3.4.1.2 IIA Elementleri
Toprak Alkali Metalleri, IA'daki alkali metallere göre daha sert olup, yoğunlukları ve erime noktaları daha yüksektir. Çünkü toprak alkali metallerin atomlarında asal gaz yapısına ilave olarak iki elektron vardır. Atomda; elektronlar (=elektron bulutu) ile 2+ yüklü iyon arasındaki Coulomb çekmesi daha kuvvetlidir ve bu çapın küçülmesine, yoğunluğun artmasına son olarak atomlar birbirine daha yakın duracağından erime noktasının daha yüksek değerler almasına neden olur. Bu gibi etkileşimler alkali metallerde olduğu gibi grupta aşağı doğru inildikçe azalmaktadır.
Toprak alkali metallerde birbirini izleyen iyonlaşma enerjileri incelendiğinde İE1 ve İE2 değerleri arasındaki farkın küçük İE2 ve İE3 arasındaki farkın ise çok büyük olduğu görülmektedir. Periyodik cetvelin diğer gruplarında olduğu gibi toprak alkali metaller grubunun ilk elementi berilyumun özellikleri grubun diğer elementlerinkinden farklıdır. Bu farklılığın temel nedeni Be2+ iyonunun çapının küçük olması dolayısı ile elektrik yük yoğunluğunu gösteren yük/çap oranının büyük olmasıdır. Be2+, Mg2+ ve Al3+ iyonlarının yük/çap oranları sırasıyla 0,039; 0,023 ve 0,044 tür. Bu değerlere göre Be2+ iyonu özellikleri Al3+ iyonuna göre daha yakındır.
Toprak alkali metaller içinde yeryüzünde en çok bulunan elementler magnezyum ve kalsiyumdur. Mineraller içinde ve deniz suyunda magnezyum, kalsiyum, stronsiyum ve baryum yaygın olarak bulunur. Endüstriyel ölçülerde üretimi yapılan tek toprak alkali metal magnezyumdur. Bunun için dolomit ısıtılarak CaO ve MgO karışımı haline getirilir. Karışım nikel kaplarda bir demir-
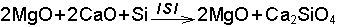
3.4.2 p Bloğu Elementleri
Periyotlar boyunca asal gazlara doğru ilerledikçe ametalik özellik daha belirgin hale gelmekte, gruplarda aşağıya doğru inildikçe ise metalik özellikler belirginleşmektedir. p bloğu elementleri diğer bloklara göre fiziksel ve kimyasal özellikler yönünden büyük bir çeşitlilik göstermektedir Bu nedenle p bloğunun birinci grubu IIIA’nın sadece birinci elementi bor ametal, diğer üyeler metalik karakter gösterir. Halojenlerin (VIIA) hepsi ametaldir.
p bloğunda periyotlar boyunca ilerledikçe elementlerin oksidasyon basamakları artmaktadır. p bloğunun asal gazlara en yakın grubu olan halojenlerdeki elementlerin çok farklı oksidasyon basamakları vardır. Bu elementler için redoks reaksiyonları çok önemlidir. Periyotların başlangıcındaki p bloğu elementleri olan bor, karbon ve silisyumun alabileceği oksidasyon basamağı sayısı azdır.
p bloğu elementlerinin ilk periyodundaki B, C, N, O ve F’un özellikleri grupların diğer elementlerinkinden çok farklıdır. Çünkü bu elementlerin atomlarında 2p nin dışındaki orbitallerin enerjileri çok yüksektir ve değerlik orbitali olarak davranmamaktadır.
Küçük yarıçaplı atomlar olan bor, alüminyum, karbon ve silisyum, oksijen ve fluor gibi ametal karakterin belirgin olduğu elementlere karşı ilgi duyarken talyum ve kurşun gibi büyük yarıçaplı olanlar ise kükürt ve iyod gibi atom çapı daha büyük olanlara ilgi duyarlar. İlgi duymak; kimyada daha kolay reaksiyona girmek anlamında kullanılır.
En yüksek değerliğin kazanılması yönünden gruplarda aşağı doğru inildikçe farklılıklar vardır. Küçük atom numaralı blok üyeleri en yüksek oksidasyon basamağını almaya yatkın iken büyük olanlarda bu yatkınlık giderek azalmaktadır. En yüksek değerliğe varma, değerlik elektronlarının tümünü kaybetme anlamındadır. Örneğin; IVA grubunun ilk elementi olan karbonda değerlik sadece 4+, grubun son elementi olan kurşunda 2+ veya 4+ olabilmektedir.
Yüksek basınç (60 atm) altında ve yüksek sıcaklıkta (2000oC) grafit yapısındaki bor nitrür, elmas yapısı kazanır. Yüzey merkezli küpten türetilen bu yapıdaki bor nitrür elmasa yakın sertlikte bir katıdır. Bu nedenle aşındırıcı zımpara ve taşlarla kesici aletlerin yapımında kullanılır.
3.4.2.1 III ve IVA Elementleri
Yeryüzünde bulunma bolluğu bakımından bu iki grubun elementleri büyük bir çeşitlilik göstermektedir. Karbon, alüminyum ve silisyum çok bol bulunurken bor çok az miktarda vardır. Bu bakımdan stratejik elementler arasında yer alan Bor minerallerinin yoğun bulunduğu bölgeler, örneğin Türkiye, özellikle önem kazanmaktadır.
Bu iki gruptaki elementlerin özellikleri arasındaki özellikler incelendiğinde çapraz benzerliklerin önemli olduğu görülmektedir. Örneğin IIIA grubunun ilk elementi olan bor, özellikleri bakımından IVA grubunun ikinci ve üçüncü elementleri silisyum ve karbona benzemektedir. Borun hemen altındaki alüminyum ise borun aksine açıkça metalik karaktere sahiptir ve metallerin belirgin bir özelliği olan sık istiflenme düzeninde kristallenmektedir. IIIA elementlerinde yüksek periyotlarda 1+ değerlik 3+ değerliğin yerini alabilir: Örneğin TlI3 bileşiğinde ilk bakışta Tl3+ ve 3 adet I-
* III ve IVA elementlerinin bazı özelliklerini görmek için tıklayınız. İyon yarıçapı 6 koordinasyon içindir. * Ek bilgi için tıklayınız.
Katı haldeki bor yapısal farklılık gösterir. Bütün bu yapılarda ikozahedral B12 birimleri vardır. İkozahedral birimlerde bor atomları arasında 3 merkezli 2 elektronlu bağlar vardır. Borun azot, oksijen ve fluor gibi elektron ilgisi yüksek elementlerle yaptığı bileşikler önemlidir. Bor, fluor ve diğer halojenlerle düzlem üçgen yapısında BX3 moleküllerini oluşturur. Bor halojenürler hidroliz olurlar. Hidroliz; Su ile kimyasal reaksiyona girmek anlamındadır.
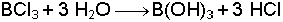
Borun oksijenli bileşiklerinden en çok bilineni borik asittir (H3BO3). Bu bileşik zayıf asitt
ir
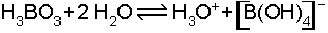
Bor azot ile de reaksiyon vermeye yatkındır. En basit azotlu bileşik olan bor nitrür, bor ok
sidin amonyakla reaksiyonu ile elde edilir.
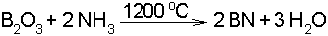
Bor nitrür (BN) karbonun C2 molekülü ile izoelektroniktir. İzoelektronik tanımlaması farklı atomlardan meydana gelen ancak aynı elektron konfigürasyonuna sahip yapılar için kullanılır. Bu nedenle katı haldeki bor nitrürün yapısı ile katı haldeki karbon arasında büyük benzerlikler vardır. Laboratuvar şartlarında bor nitrür, grafit yapısında bir katı oluşturur. Grafitte birbirini izleyen düzlemlerdeki karbon atomları çapraz konumlardadır. Bor nitrürde ise birbirini izleyen düzlemlerdeki bor atomları ile azot atomları aynı hizadadır. Grafitte olduğu gibi düzlemlere dik p orbitallerinin oluşturduğu çok zayıf bağlar vardır. Bu nedenle düzlemler birbiri üzerinde kolaylıkla kayabilirler. Grafit yapısındaki BN, renksiz ve kaygan bir maddedir. Makinelerin hareket eden parçaları arasındaki sürtünmeyi azaltmak amacıyla kaydırıcı madde olarak kullanılır. Grafit elektriği iyi ilettiği halde, bor nitrür yalıtkandır.
Yüksek basınç (60 atm) altında ve yüksek sıcaklıkta (2000oC) grafit yapısındaki bor nitrür, elmas yapısı kazanır. Yüzey merkezli küpten türetilen bu yapıdaki bor nitrür elmasa yakın sertlikte bir katıdır. Bu nedenle aşındırıcı zımpara ve taşlarla kesici aletlerin yapımında kullanılır.
3.4.2.1 IIIA Elementleri
Alüminyum ve Galyum elektrik iletkenlikleri yüksek, gümüş beyazı renginde metallerdir. Alüminyumun erime sıcaklığı oldukça yüksek (659,7oC) olduğu halde galyum çok düşük sıcaklıkta sıvı hale geçer (30oC). Kaynama sıcaklığı 2403oC olan galyumun sıvı halde bulunduğu sıcaklık aralığı çok geniştir.Alüminyum ve galyum 3+ değerlikli bileşikler oluşturmakla birbirine benzer. Ancak galyumun 1+ ve 2+ değerlikli kararlı bileşikleri de vardır.Alüminyum doğadaki boksid mineralinden elde edilir. Al2O3 çok sert bir katıdır. Alüminat denilen bu oksit içinde safsızlık olarak Fe ve Ti bulunması, kristale güzel bir mavi renk kazandırır. Safir olarak adlandırılan bu kıymetli taşa mavi rengi veren Fe ile Ti arasında elektronik yük aktarım geçişinin olmasıdır. Alüminatın içinde Cr3+ iyonu varsa diğer bir kıymetli taş türü olan yakut meydana gelir.
Karbonun grafit, elmas ve karbon siyahı olmak üzere üç allotropu vardır. Bir elementin atomlarının farklı dizilişleri ile oluşan yapı türlerine allotrop denir. Bu allotroplar arasında 3,51 g/cm3 değeri ile yoğunluğu en yüksek olan elmastır. Yoğunluk grafit için 2,25 g/cm3, karbon siyahı için 1,88 g/cm3 kadardır.
Elmas yapısında; karbon atomları düzgün dörtyüzlü düzen içinde birbirlerine bağlanmışlardır. Elmasta C-
3.4.2.1.2 Karbon
Grafit, elektrik iletkenliği olan yumuşak kaygan siyah renkli bir katıdır. Grafit kristallerinin iletkenliği doğrultuya göre değişir (anizoropik iletkenlik). İletkenliğin yüksek olduğu tabaka düzlemlerine dik doğrultuda iletkenlik düşüktür. Grafitte hekzagonal düzende yerleşmiş karbon atomlarından oluşan katmanlar vardır. Bu katmanlardaki bağ açıları 120o ve bağ uzunlukları 142 pm'dir. Bağ uzunluğu benzendeki C-
Karbon siyahına amorf karbon da denir (amorf karbon terimi belirli bir kristal şebeke düzeni içermeyen katılar için kullanılır). Ancak karbon siyahı tam anlamıyla amorf değildir. Grafit yapısının hekzagonal düzendeki düzlemlerin birbiri üzerine kıvrılması ile oluşan çok küçük kristaller karbon siyahını oluşturur. Aktif karbon ise karbon siyahına benzeyen ve kısmen kristal yapısı gösteren bir maddedir. Aktif karbon, tohum kabukları gibi organik maddelerin ısıtılarak kömürleştirilmesinden elde edilir. Aktif karbon, birim kütle başına çok geniş bir yüzey gösterir. Bir gram aktif karbonun gösterdiği yüzey 1000 m2'dir. Bu nedenle zehirli gazların tutulması amacıyla kullanılır.
Yeni keşfedilen ve özellikleri tüm ayrıntıları ile ortaya konulmaya devam edilen C60 molekülü de karbonun allotropları arasında sayılmalıdır. Altmış karbon atomundan oluşan C60 molekülü bir futbol topu şeklindedir. İçi boş olan bu kürenin yüzeyinde düzgün altıgen ve beşgen halkalar vardır. Moleküldeki bütün karbon atomları birbirinin aynıdır. C60 molekülü bazı özellikleri nedeniyle oldukça ilgi çekicidir. Bunlar arasında küre şeklindeki molekülün içinde boşluk bulunması en önemli özelliğidir. Bu boşluğa potasyum katyonu yerleştirilerek moleküle iletkenlik kazandırmak mümkündür. C60 molekülü alkanlarda kolayca çözünür. Benzenin elektrik arkında yanması sırasında çok az miktarda elde edilebilen C60 molekülü birçok bilisel araştırmaya konu olmaktadır.
Kısmen kristal özelliği gösterebilen karbon allatropları otomobil lastiklerinin dayanıklılığını arttırmak amacıyla katkı maddesi olarak kullanılır.