Tel:
Fax:
Email:

www.hayatiboskut.com.tr


















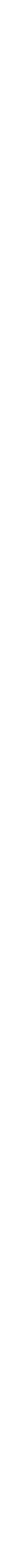



3.3.1 Metalik Karakter ve Oksijene Karşı Reaktivite
Metalik karakter iyonizasyon potansiyelinin, dolayısı ile etkin çekirdek yükünün doğal bir sonucudur. Bu bakımdan metalik özellikler iyonizasyon potansiyelinin arttığı yönde (periyodik cetvelde sağa doğru) azalır, azaldığı yönde (aşağıya doğru) artar. 6A ve 7A grubu elementleri Polonyum hariç olmak üzere kuvvetli ametal özelliğe sahiptirler. Buna göre metalik karakterin en belirgin olduğu grup 1A, en belirgin olduğu element Fransiyum olmalıdır. Karşılık olarak en kuvvetli ametal özellikler de Fluor başta olmak üzere halojenlerde görülmektedir.
Metalik karakterin derecesine bağlı olarak, elementlerin su ve OH grubu taşıyan bileşiklerle reaksiyona girme eğilimi sağa ve yukarıya doğru azalır. 1 ve 2A grubu elementleri su ile çok şiddetli ekzotermik
reaksiyonunu verirken 7A grubuna doğru gidildikçe reaksiyon ısısı azalır; ametal karakterinin hakim olduğu p bloğunda bu reaksiyonu gerçekleştirmek pratikte pek mümkün olmaz ya da çok yüksek sıcaklıklar gerektirir.Periyodik cetvelde yer alan hemen her üye için, reaksiyon yeteneğinin önemli bir ölçüsü oksijen elementi ile birleşme yatkınlığıdır. Oksijene karşı aktivite periyot boyunca sağ tarafa doğru azalma eğilimi gösterir. 1A ve 2A elementleri oksijen ile takip edilebilir bir hız ile birleşirken, kesilen sodyum yüzeyinin hemen matlaşması gibi, d bloğu elementleri için bu süre çok uzun olabilir. Ancak, p bloğunda durum farklıdır. Örneğin, fosfor ve fluor oksijene karşı çok hassastır. Bunun yanında azot ve kükürt normal şartlarda pasiftir. Bunun nedeni atom çapının değeridir.
Atom çapının belirleyici bu etkisi s ve d bloklarındaki gruplar için de geçerlidir.
Özetle; oksijen ile reaksiyona girme eğiliminin bazı özel etkenler dışında, metalik karakter ile el ele gittiği söylenebilir.Elementlerin kimyasal reaksiyon yeteneklerini herhangi bir diğer elementi, örnek; klor, kükürt vb. gibi, referans alarak belirlemek de mümkündür. Her halde; kimyasal aktivite için yukarıda bahsedilenlere benzer eğilimler tespit edilecektir.
3.3.2 Bileşiklerin Kimyasal Özellikleri
Elementlerde görülen kimyasal davranış biçimlerinin periyodik değişimi, aynı sınıftan bileşiklerin bazı özelliklerinde de kendini gösterir.
Örneğin; Hidroksit bileşiklerinin asit-
Aynı grup içinde hidroksit bileşiklerinin asit-
Bölünmenin nereden olacağı E elementinin elektron ilgisine bağlıdır. Alkali ve toprak alkali metallerin az olan elektron ilgileri E–O bağındaki elektron çiftinin kolayca oksijen üzerine terk edilmesine yol açtığı için bölünme; E+ ve OH-
3.3.3 Element Oksitlerinin Asit-
reaksiyonları göz önüne alındığında Na2O bazik oksit, SO2 de asidik oksittir.
Elementlerin hidroksit bileşiklerinin asit-
3.4 Element ve Bileşiklerin Özelliklerinin Periyodik Değişimi
Özelliklerin periyodik değişiminin daha net anlaşılmasını sağlamak için, bloklar içinde inceleme yapmak daha doğru bir yoldur. Çünkü her blok içinde benzerlikleri ve farklılıkları tespit etmek daha kolaydır. Bu bölümde element ve bileşiklerin genel özellikleri periyodik cetvelin sistematiği göz önünde bulundurularak verilecektir.Özelliklerin periyodik değişimi, oksit ve hidroksit bileşiklerinde olduğu gibi bütün bileşik sınıflarında da görülür. Klorür bileşiklerinin çözünürlüğü, karbonatların termik dayanıklılığı, oksitlerin uçuculuğu gibi birçok kimyasal ve fiziksel özellik peryodik değişim kuralına uyar. Değişimde dikkate alınan temel parametre atom numarası olmakla birlikte özelliklerin ayrıntılı incelenmesinde etkin çekirdek yükü başta olmak üzere Atom çapı, yük/yarıçap oranı ve orbital özellikleri de parametre olarak kullanılmalıdır.
3.4.1 s Bloğu Elementleri
Periyotlar cetvelinde metallerin ametal karakteri asal gazlara doğru gidildikçe artmakta, gruplarda aşağı doğru inildikçe azalmaktadır. Asal gazlar da ametal özellikleri gösterir. s bloğu cetvelin en solunda yer alır. Bu nedenle en belirgin metal özellikleri bu elementlerde görülür.
Metallerde periyodik özellikler oldukça düzenli olarak değişir.
Metallerin erime noktaları ve sertlikleri, alkali metallerden başlayarak geçiş metallerinin ortalarına (grup VIB) kadar yükselir. Geçiş metallerinde sertlik ve erime noktası daha sonra düşmeye başlar. Geçiş metallerinin son grubu IIB elementlerinin erime sıcaklıkları düşük ve sertlikleri azdır. Geçiş metallerinden hemen sonra gelen elementler de düşük erime noktaları olan yumuşak metallerdir. Örneğin IVA grubundaki Sn ve Pb ile VA grubundan Sb ve Bi erime noktası düşük alaşımların yapımında kullanılırlar. Bu arada dikkat çekici bir örnek Galyum’dur. Bütün elementler içinde en geniş sıvı hal sıcaklık aralığına sahip IIIA elementidir. (e.n= 29,8oC, k.n= 2250oC).
Metallerin reaksiyon yatkınlığının iyonlaşma enerjileri ile açıklanabileceği şeklinde genel bir düşünce vardır.
Nitekim birinci iyonlaşma enerjileri (İE1) düşük olan alkali metallerin reaksiyon yatkınlıkları yüksektir. Bununla beraber metallerin yüksek değerlikli olduğu kararlı bileşikler vardır. İyonlaşma olayı enerji gerektiren bir olaydır. Çok sayıda elektronun koparılması büyük miktarlarda enerjiyi gerektirir. Ancak oluşan iyonun elektrik yükü yüksek, çapı küçük olduğundan yük/çap oranları büyüktür. Böyle iyonların oluşturduğu iyonik şebeke yapılı bileşiklerin de katı haldeki örgü enerjisi ve sulu çözeltilerindeki hidratlaşma enerjileri yüksek olur.
3.4.1.1 IA Elementleri
Alkali metal geleneksel tanımlaması ile bilinen IA elementleri atomlar arasındaki bağın zayıf olması nedeniyle erime noktası düşük, yumuşak metallerdir. Asal gaz elektron dizilişinin dışında, sadece bir elektron bulunduğundan, katı halde iken elektron bulutu ile pozitif yüklü iyonlar arasındaki çekme kuvveti zayıftır.
Grupta aşağıya doğru inildikçe erime ve kaynama noktaları düşmekte ve sertlik azalmaktadır.
Beklendiği gibi büyük çaplı iyonlar ile elektron bulutu arasındaki çekim kuvveti küçüktür. Metallerin yoğunluğu yukarıdan aşağıya doğru artmaktadır. Fakat yoğunluğu sodyumdan küçük olan potasyum aykırı davranmaktadır.Yer kabuğunda en çok bulunan alkali metaller sodyum ve potasyumdur. Bu elementler yer kabuğunun önemli bir bölümünü oluşturan alüminosilikatlarda bulunurlar. Çok az bulunan rubidyum ve sezyumun minerallerine nadir rastlanır. Çoğunlukla potasyum minerallerinin içinde bulunurlar. Lityum, yarıçapının çok küçük olması nedeniyle, minerallerde sodyum veya potasyumun yerine geçemez. Doğada lityum, alüminosilikatlarda magnezyum ile birlikte bulunur. Bu özellik periyot cetvelinde gözlenen çapraz ilişkilerin bir sonucudur.Alkali metaller için genel elde edilme yöntemi, eritilmiş tuzların veya hidroksitlerin elektrolizidir. Sodyum ve lityum erimiş klorür tuzlarının elektrolizi ile elde edilir. Ağır alkali metaller de elektroliz ile elde edilebilir. Bu metallerin elde edilmesinde indirgenme reaksiyonları da önemlidir. Örnek; Potasyum fluorür tuzunun (KF) CaC2 ile indirgenmesiyle ele geçer.

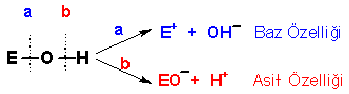
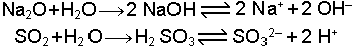
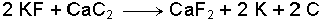
Potasyum klorürün sodyum ile indirgenmesiyle oluşan K-