Tel:
Fax:
Email:

www.hayatiboskut.com.tr




















3.2.2 İyonizasyon Enerjisi
Gaz fazında bulunan temel haldeki bir atomdan bir elektron koparmak için gereken enerjiye iyonlaşma enerjisi denir.
Elektronun koparılması için elektriksel alan kullanıldığından, bu enerji iyonlaşma potansiyeli şeklinde de adlandırılır. İyonizasyon potansiyelleri daima endotermiktir ve + işaretlidir. Nötr atomdan bir elektron koparıldığında harcanan enerjiye 1. İyonlaşma enerjisi (İE1) ya da 1. İyonizasyon potansiyeli (İP1) denir. 1+ yüklü bir katyonda bir elektron koparılmışsa 2. İyonlaşma enerjisi (İE2), 2+ yüklü bir katyondan bir elektron koparılmışsa 3. İyonlaşma enerjisi (İE3) vb... söz konusudur.
Atom yarıçapı konusunda bahsedilen etkenler iyonlaşma enerjileri için de geçerlidir. Elektronun bulunduğu orbitalin baş kuantum sayısının (n) büyük olması, elektronun çekirdekten daha uzakta olmasına ve dolayısıyla daha az bir kuvvetle çekilmesine neden olacağından böyle bir elektronu atomdan uzaklaştırmak için gerekli enerji de o derece küçük olacaktır. Etkin çekirdek yükünün (Z*) büyük olması halinde elektron çekirdek tarafından daha çok çekileceğinden iyonlaşma enerjisi büyük değerler alacaktır.
Periyodik cetvelin her grubunda aşağıya doğru inildikçe iyonlaşma enerjisi küçülür, bir periyot boyunca sağa gidildikçe iyonlaşma enerjisi büyür.
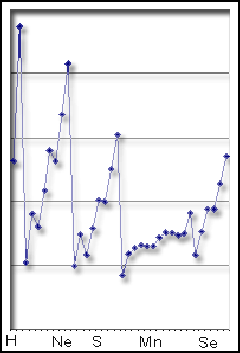
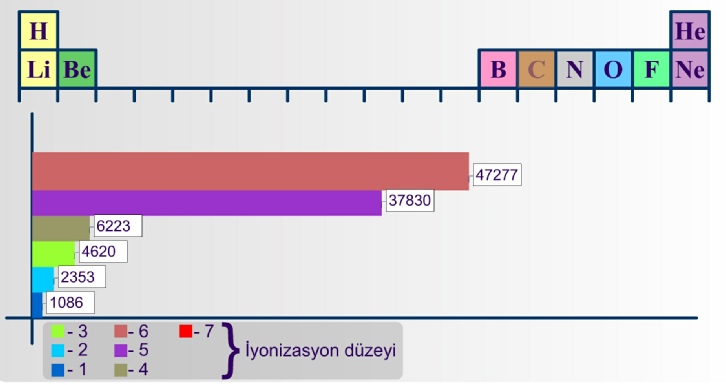
İyonizasyon enerjisi değişiminin elementlere göre nasıl farklılaştığını görmektesiniz.
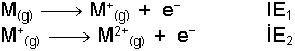
3.2.3 İyonizasyon Enerjisinin Değişimi
İyonlaşma enerjisinin periyotlar boyunca artması tamamen düzenli değildir. Bunun nedeni yarı dolu alt orbitallerde paralel spinli elektronların bulunmasının atomdaki elektron düzeninin kararlılığını arttırmasıdır. Pauli İlkesi'ne göre; paralel spinli elektronlar birbirini iter ve birbirlerinden uzaktadırlar. Bunun sonucunda, elektronlar arasındaki itme kuvveti küçülür ve atom daha kararlı bir elektronik sisteme sahip olur ki, bu iyonizasyon enerjisinin büyümesi demektir.
Sonuç olarak; eşleşmemiş elektron sayısının çok olması iyonlaşma enerjisinin değerini de arttırmaktadır. Bu etki, etkin çekirdek yükü yanında iyonizasyon enerjisinin büyüklüğünü belirleyen ikincil bir etkendir.
2. periyotta azot atomunun kendisinden sonra gelen oksijen atomundan daha büyük İE1 değeri alması da bu yüzdendir. Çünkü yarı dolu p orbitallerine sahip azot atomundan bir elektron koparmak oksijenden bir elektron koparmaktan daha güçtür. Bunun yanında Aufbau İlkesi'ne aykırılık gösteren krom ve bakırın elektron dizilişlerinin açıklaması da bu şekilde yapılabilmektedir.
Benzer şekilde en dış orbitallerin tam dolu olması da kararlılığı en üst düzeye taşır. En dış s ve p orbitallerinin tam dolu olması halinde kazanılan kararlılık en fazla olandır. Bu nedenle böyle elektron dizilişlerine sahip asal gazların iyonlaşma enerjileri çok yüksektir.1. İyonlaşma enerjileri için açıklanan yaklaşımlar 2, 3, 4... iyonlaşma enerjileri için de geçerlidir. İyonlaşma enerjileri incelendiğinde sodyumun 2. İyonlaşma enerjisinin 1. İyonlaşma enerjisinden çok büyük olduğu, buna karşılık magnezyumun 1. ve 2. İyonlaşma enerjileri arasındaki farkın büyük olmadığı görülmektedir. Çünkü bir elektronunu kaybeden sodyum tam dolu orbitallere sahip olurken, magnezyum böyle bir elektron düzenine ancak iki elektron vererek ulaşabilmektedir. Tablo incelendiğinde atomların elektron dizilişleri ile iyonlaşma enerjileri arasında buna benzer ilişkilerin bulunduğu görülür.
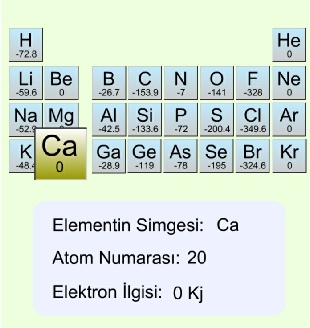
3.2.4 Elektron İlgisi
Gaz fazındaki bir atom veya iyona bir elektron ilave edildiği zaman açığa çıkan enerjiye elektron ilgisi denir. Açığa çıkan enerji olarak tanımlandığı için elektron ilgisi değerlerinin işareti genel termodinamik işaretleme kurallarına uymaz. Örneğin;
reaksiyonu ekzotermik olduğuna göre H= +337 kjmol-
Bu değişme endotermiktir ve H= +337 kjmol-


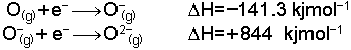
Elektron ilgilerini daha yakından görmek için elementlerin üzerine gidiniz.
Kristal yapıda kazanılmış olan yüksek örgü enerjileri O2-
Elementlerin Eİ1 değerleri, iyonlaşma enerjilerinde olduğu gibi, aynı grup içinde aşağıya inildikçe azalır. Ancak; 2. periyot elementlerinde bir sapma görülür. Bunun nedeni, atom yarıçaplarının küçük, elektronlar arası itmenin büyük olması ve dolayası ile yeni elektron katılmasının güç olmasıdır. Bu yüzden 7. grubun 3. periyodunda bir maksimum gözlenir. 3, 4, 5 ve 6. gruplarda bu maksimumlar 4. periyoda kaymaktadır.
Periyotlar boyunca sağa gidildikçe elektron ilgisi artmaktadır. Bu eğilim 5, 6 ve 7. grup elementlerinin elektron ilgileri karşılaştırıldığında açıkça görülmektedir. Ayrıca geçiş metallerinin (n-
3.3 Genel Kimyasal Özellikler
D. Mendeleev tarafından yapılan henüz keşfedilmemiş elementlerin özellikleri ile ilgili tahminlerin doğruluğu komşu elementlerin benzer olmalarındandır. Genelde aynı grupta bulunan elementler özellikle kimyasal bakımdan oldukça yakın benzerlikler taşırlar. Ancak, benzerlikler bazı hallerde; komşu gruptan elementler ile de olabilir. Bu durum ikinci ve üçüncü grup elementleri arasında tespit edilmiştir.
Komşu gruptaki bir başka üyeye benzerliğin en belirgin nedenlerinden biri yük/yarıçap oranı yakınlığıdır. Belirgin olarak; Li+–Mg2+ , Be2+–Al3+ çiftlerinde görülür. Diğer çapraz benzerlik ise; B–Si, C–P, N–S, O–Cl gibi kovalent etkileşime eğilimli çiftler arasında ortaya çıkan yakın elektronegativite değerleri nedeniyledir. Kimyasal özelliklerin bir periyot içindeki değişimi de doğal olarak fiziksel özellikler ile paralellik gösterir ve bu yüzden tedricen olur.