Tel:
Fax:
Email:

www.hayatiboskut.com.tr


















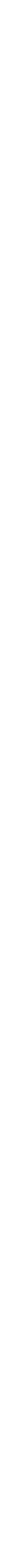



3.4.2.1.3 IV A Elementleri
Karbon fiberler kısmen kristal katılar grubundadır. Karbon fiberler asfalt fiberlerin veya sentetik fiberlerin karbonize edilmesi ile elde edilirler. Bu fiberlerin gerilmeye karşı dirençleri yüksektir. Kısmen kristal özelliği gösterebilen karbon allatropları otomobil lastiklerinin dayanıklılığını arttırmak amacıyla katkı maddesi olarak kullanılır.
Karbonun azotlu bileşiklerinin en basiti hidrojen siyanürdür (HCN). Bu bileşik katalizörlerin etkisi altında amonyak ile metanın reaksiyonu sonucunda oluşmaktadır. Hidrojen siyanür çok zehirli bir gazdır. Siyanür anyonu (CN-
IVA elementlerinden Silisyum ve Germenyum elektronik endüstrisi için çok önemlidir. Silisyum, silisyum dioksidin karbon veya kalsiyum karbür ile; Germanyum da germanyum dioksidin hidrojen veya karbon ile indirgenmesiyle elde edilir. Ancak elektronik endüstrisinde çok saf silisyum ve germanyuma ihtiyaç vardır. Bunun için önce silisyum veya germanyumun tetraklorür veya tetraiyodür bileşikleri elde edilir (SiCl4/SiI4, GeCl4/GeiI4). Fraksiyonlu destillasyon ile madde bor ve fosfor içeren safsızlıklarından arındırılır. Daha sonra halojenür bileşikleri ısıtılarak metal ve halojene ayrılır ya da hidrojenle indirgenir.
Kalay eldesi kalaydioksidin karbon ile indirgenmesiyle olur. Kalay 13oC nin altındaki sıcaklıklarda gri kalay ( -
Kurşun ise doğada daha çok sülfür mineralleri halinde bulunur. Kurşunsülfür karbon ile indirgenemez. Bunun için kurşunsülfür önce havada kavrularak kurşunoksit haline çevrilir ve sonra indirgenir. * Ek bilgi için tıklayınız.
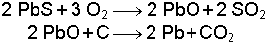
Kurşun sülfürün yakılması sırasında sınırlı ölçüde hava kullanıldığında, oluşan kurşunoksit ile kurşun sülfür reaksiyona girer ve element halinde kurşun oluşur.
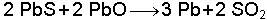
Kurşun sadece kübik sıkı istiflenme düzeyinde kristaller oluşturur. Sıkı istiflenme yapısı metallere özgüdür. Böylece grupta aşağıya doğru inildikçe metal özelliğinin arttığı görülmektedir.
3.4.3 V ve VI A Elementleri
Periyodik cetvelin ikinci periyodundaki elementlerin diğer periyotlardaki elementlerden çok farklı olması hali, bu gruplar için de geçerlidir. Grupların ilk elementleri azot ve oksijen doğada gaz halinde bulunurken diğerleri katı haldedir. III ve IVA gruplarının ağır elementleri metal özelliği taşırken, V ve VIA'daki elementlerin hiçbiri gerçek metal değildir. Bu gözlem periyodik cetvelde asal gazlara doğru ilerledikçe metal özelliğindeki azalma eğilimine uymaktadır.Bu iki gruptaki elementlerin birçoğu çok çeşitli değerliklerde olabilmektedir. Bu nedenle bileşikleri çok çeşitli redoks değişimleri göstermektedir.Grup VA'nın ilk elementi olan azot bu grubun en yüksek değerliği olan 5+ oksidasyon basamağını alabilmektedir. Grubun sonuncu elementi bizmutun en yüksek değerliğe varabilmesi için çok kuvvetli yükseltgen maddeler gereklidir. Bunun nedeni büyük atomlu elementlerde gözlenen kararlı elektron çifti etkisidir.Grup VIA'nın ilk elementi olan oksijenin 6+ değerlikli bileşiği yoktur. Grubun diğer elementlerinin en yüksek değerlikte (6+) olduğu bileşikler vardır. Ayrıca ilk elementler olan azot ve oksijen, moleküllerinde koordinasyon sayısının 4'ten yüksek olduğu çok az sayıda bileşik yapar. Her iki grubun diğer elementlerinde koordinasyon sayısı 5 ve 6 olan hallere sık rastlanmaktadır.
3.4.3.2 Fosfor
Fosfor elementi çeşitli allotroplar halinde bulunur. Bunlardan beyaz fosfor ve kırmızı fosfor önemlidir. Beyaz fosfor, tetrahedral yapıda P4 moleküllerinden oluşmuştur. Açık sarı renkli beyaz fosfor oda sıcaklığında havanın oksijeni ile birleşerek yanar. Termodinamik verilere göre beyaz fosfor diğer allotroplar kadar kararlı olmadığı halde yapısının belirgin olması nedeniyle fosfor elementinin standart hali olarak kabul edilir. Kırmızı fosfor ise beyaz fosforun 300oC'de oksijensiz ortamda birkaç gün ısıtılmasıyla elde edilir. Kırmızı fosfor genellikle amorf katı halinde elde edilir. Bu madde üç boyutlu karmaşık ağ örgülü kristaller haline dönüştürülebilir. Beyaz fosforun aksine kırmızı fosfor açık havada kendiliğinden yanmaz.
Fosfor yüksek basınç altında ısıtıldığında siyah fosfor denilen bir fosfor allotropu oluşur.Doğada fosfor tortul kayalarda eski organizmaların atıkları olarak bulunur. Fosfat kayalarında başlıca florapatit Ca5(PO4)3OH mineralleri vardır. Bu minerallerin 1300-
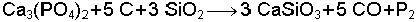
V ve VIA Elementlerinin Bazı Özellikleri
* Elementel halde ve yakın atom çapına sahip diğer atomlarla oluşturduğu bileşiklerde aldığı yarıçap değeri
** İyon yarıçapı 2-
G: gaz, K: katı, k: kırılgan, r: radyoaktif
3.4.3.1 Azot
Azot elementi diatomik N2 molekülü halindedir. Atmosferin hacimce %78,09'u azottan ibarettir. Azot için en önemli kaynak havadır. Sıvı havanın fraksiyonlu destillasyonundan azot, oksijen ve asal gazlar elde edilir. Azot –195,8o C'de oksijen –183,0oC'de kaynar. Buna göre havanın destillasyonunda önce azot, sonra oksijen buharlaşır. Halen sanayide kullanılan azotun hemen tümü havadan bu yolla üretilmektedir.
N2 molekülü reaksiyon vermeye yatkın değildir. Bunun çeşitli nedenleri arasında şunlar söylenebilir. Azot molekülündeki üçlü bağın kırılması için gereken enerji yüksektir. N2 molekülü elektron transferinin olduğu redoks reaksiyonlarına da kolaylıkla giremez. Nispeten küçük atomlardan oluşan N2 molekülünde elektronlar çekirdekler tarafından kuvvetle tutulur ve elektronik yapı kararlılık kazanır.
Azot canlı organizmaları oluşturan çeşitli proteinlerin temel elementidir ve tüm canlılar azot bileşikleri kullanırlar. Bu bakımdan azot bileşiklerine gübre ve ilaç endüstrisi başta olmak üzere çok çeşitli alanlarda ihtiyaç vardır. Molekül halindeki azotun çeşitli değerliklerde azot bileşikleri haline dönüştürülmesi bu bakımdan büyük önem taşımaktadır. * Ek bilgi almak için tıklayınız.
Azotun bir dizi oksidi vardır. Bunlar; N2O, NO, N2O3, N2O4 ve N2O5'tir. Diazotmonoksit, amonyum nitratın pek yükseltgen olmayan sıcaklıklarda ısıtılmasından elde edilir. Isıtırken çok dikkatli olmak gerekir. Çünkü amonyum nitrat patlayıcı bir maddedir. Amonyum nitratın patlayıcı olmasının nedeni aynı bileşikte azotun iki farklı değerlikte (3-

Diazotmonoksit, reaksiyonlara yatkınlığı yüksek olmayan bir bileşiktir. Evvelce anestezi amacı için kullanılan N2O sınırlı bir narkotik etkiye sahiptir ve güldürücü gaz olarak bilinir.
Reaksiyonda elde edilen P2 buharları suya gönderilir ve beyaz fosfor (erime noktası 44oC) elde edilir. Fosforun su içinde toplanmasının en önemli nedeni, havanın oksijeni ile reaksiyona girmesini engellemektir. Bu yöntemle elde edilen saf fosfor, çeşitli bileşiklerin elde edilmesinde kullanılmaktadır.Fosforun tam olarak yanması fosfor(V)oksidi (P4O10) oluşturur. Bu bileşikte fosfor atomları bir düzgün dört yüzlünün köşelerindedir. Fosfor atomlarının her birinde birer terminal oksijen atomu vardır. Ayrıca kenar ortalarında da birer köprü oksijeni bulunmaktadır.
Fosforun az oksijen ile yakılmasından fosfor(III)oksit (P4O6) oluşur. Bu yapıda fosfor(V) oksitten farklı olarak terminal oksijen atomları yoktur. Fosfor(III)oksit, fosforöz asidin (H3PO3) anhidritidir.Fosfor(V)oksidin su ile reaksiyonundan son ürün olarak ortofosforik asit oluşur. Fosfor(V)okside katılan su miktarına bağlı olarak birçok ara ürünler de oluşmaktadır. Bu ara maddelerden en önemlileri metafosforik asit ve difosforikasittir.
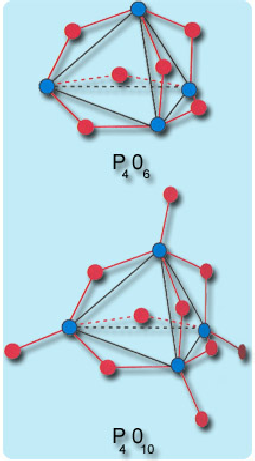
P4O6 ile P4O10 molekülerinin yapısını görmektesiniz.Kırmızı daireler oksijeni, mavi daireler ise fosforu temsil etmektedir.