Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















3.4.3.3 Arsenik, Antimon, Bizmut ve Oksijen
Arsenik, Antimon ve Bizmut sülfür filizlerinden elde edilir. Filizler kavrularak elementler oksitleri haline getirilir. Sonra oksitler karbon ile indirgenir. Buhar fazında üç metal de tetramer (Me4) halinde bulunur. Antimon ve arseniğin sarı renkli katı hallerinde de tetramerler vardır. Sarı renkli katılar kararlı değildir. Elementlerin kararlı hali gri renkli formlarıdır.Bu elementlerin hepsi havada yanarlar ve trioksitleri oluştururlar. Halojenlerle birleşerek ikili bileşikler oluştururlar ve yükseltgen olmayan asitlerden etkilenmezler. Derişik nitrik asitle birleşerek As2O5, Sb2O5 ve Bi(NO3)3'ü verirler.Bizmut metal parlaklığı olan bir katıdır. Su gibi katılaştığında genleşen çok az sayıdaki maddelerden biridir. Bizmutun elektrik iletkenliği diğer metaller kadar yüksek değildir. Ayrıca metalik katıların aksine bizmut kristallerinde yöne bağımlılık vardır. Bu yönüyle bizmuta metal yerine yarımetal demek daha doğru olur.
Oksijen yerkabuğunun ağırlıkça % 46,6’sını meydana getirir. Oksijen, ağırlığının yaklaşık yarısını oluşturduğu yerkabuğunda, hidrojen, silisyum ve metal oksitleri halinde bulunur. Element halinde oksijen elde etmek için ise oksit kaynakları yerine atmosferden yararlanılır. Hacimce % 20,9’u oksijen olan havanın sıvılaştırıldıktan sonra fraksiyonlu destillasyonundan azot ile birlikte elde edilir.Oksijenin sadece iki allotropu vardır; oksijen (=dioksijen, O2) ve ozon (O3). Oksijen, normal şartlarda renksiz, -
Oksijenin hidrojen ile yaptığı bileşikler H2O ve H2O2’ dir. Yüksek dielektrik sabiti, büyük dipol momenti ve hidrojen köprüsü yapabilmesi nedeni ile H2O bilinen en iyi çözücüdür. H2O2, asidik çözeltilerde kuvvetli bir yükseltgen, bazik çözeltilerde ise zayıf bir indirgendir. Hidrojen peroksidin bu özelliği ilgili redoks potansiyellerinde görülmektedir.
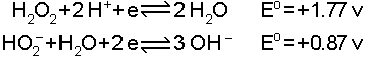
İkinci reaksiyonun standart indirgenme potansiyelinin düşük olması, hidrojen peroksidin ancak kuvvetli yükseltgenler karşısında indirgen olarak davranabileceğini göstermektedir.Oksijen alkali ve toprak alkali metaller ile oksitler, peroksit ve süperoksit bileşikleri oluşturur. Bu oksitlere örnek olarak Li2O, Na2O2 ve KO2 verilebilir. Bu oksitlerdeki oksit, peroksit ve süperoksit iyonlarının yükleri sırasıyla 2-
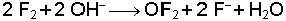
Oksijen diğer halojenlerle değişik değerliklerde bileşikler oluşturur. Örneğin klor ile yaptığı bileşiklerde klor 1+, 4+, 6+ ve 7+ değerliklerini alır. Bunlar; Cl2O (sarı esmer gaz), ClO2 (sarı gaz), ClO3 (koyu kırmızı sıvı) ve Cl2O7 (renksiz sıvı) ile gösterilen bileşiklerdir
3.4.3.4 Kükürt
Kükürt, tabiatta genelde sülfürleri halinde bulunmakla birlikte bazı bölgelerde elementel halde de rastlanır. Tortul kayalarda bulunan sülfatlar (örneğin, CaSO4) sülfürlerin oksitlenmesiyle oluşmuştur. Sülfatların bakteriler tarafından indirgenmesi sonucunda H2S ve H2S de çevredeki sülfatlar ile reaksiyona girerek element kükürdü verir. Kükürdün büyük bir çoğunluğu, element halde kükürt içeren yataklardan elde edilir. Elde edilen kükürdün yaklaşık %85'i sülfat asidi üretiminde kullanılır.
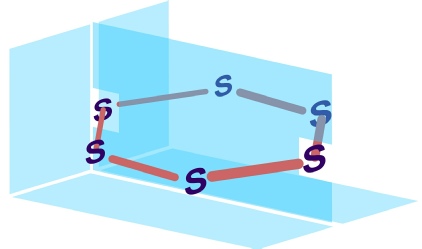
VIA’nın büyük atomlu elementleri oksijende olduğu gibi çift bağ oluşturma eğiliminde değildir. Kükürt de oda sıcaklıklarında tekli bağlarla birbirine bağlı atomlardan oluşan moleküller halinde bulunur. Ancak yüksek sıcaklıklarda kükürt buharları çift bağlı S2 (S=S) molekülleri içerir.Kükürdün çok çeşitli allotropları vardır. En kararlı allotropu, ortorombik -
kükürt S8 birimlerinden oluşmaktadır
Ortorombik kükürt 113oC’de erir ve sarı renkli sıvı haline dönüşür. Isıtılmaya devam edildiğinde sıvı kükürdün rengi 160oC’nin üstünde koyulaşır ve akışkanlığı giderek azalır. Akışkanlıktaki azalmanın nedeni halkaların açılması ve helis şeklinde Sn polimerlerinin oluşmasıdır. Bu koyu sıvı, soğuk suya akıtılarak birdenbire soğutulursa esnekliği yüksek amorf kükürt elde edilir. Amorf kükürt oda sıcaklığında bekletildiğinde -
Kükürdün hidrojenli bileşiklerinin en önemlisi hidrojen sülfür H2S 'dir. Hidrojen sülfür kötü kokulu zehirli bir gazdır. Sulu çözeltisi zayıf asidik reaksiyon verir. VIA’nın diğer elementleri de hidrür bileşikleri verir. Bu hidrürlerin asitliği; H2S < H2Se < H2Te sırasını izler. Asitliğin bu sıraya göre artmasının nedeni grupta aşağı doğru inildikçe merkez atomunun çapının büyümesidir.
Geçiş metalleri kükürt ile disülfürleri verir. Bu bileşikler iki türdür. Birincisinde 2+ değerlikli metal S22-
3.4.4 VII A Elementleri
Halojen geleneksel tanımlaması ile bilinen VIIA elementlerinin çok farklı kimyasal özellikler gösteren bileşikleri mevcuttur. Şüphesiz bu durum 1-
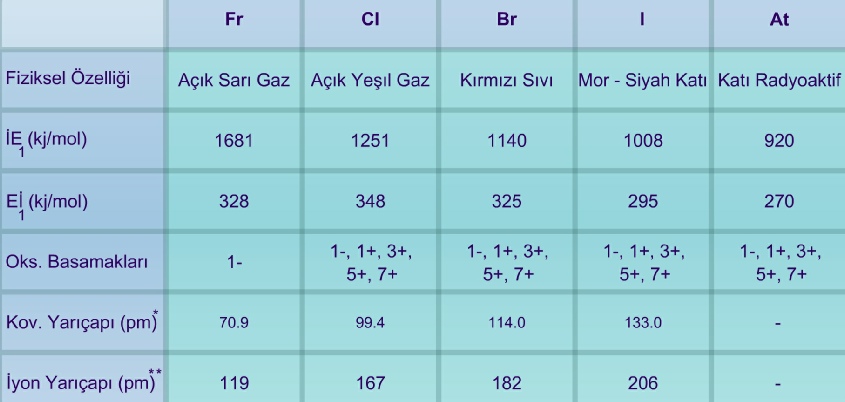
p bloğunun diğer elementlerinde olduğu gibi halojenlerin ilk elementi diğerlerinden farklı özellikler göstermektedir. Fluor İE değeri en yüksek olmasına rağmen, Eİ değeri klordan küçüktür. Bu aykırılığın nedeni atom yarıçapının küçük olması ve elektronlar arası itme kuvvetinin büyük olmasıdır. Elektron ilgisi küçük olduğu halde fluor, iyonik yapıda kararlı bileşikler oluşturur. Çünkü yarıçapı küçük fluorür iyonlarının bulunduğu yapıda örgü enerjisi büyüktür. Örgünün oluşması ile açığa çıkan enerji elektron ilgisinin küçük olmasının getirdiği güçlüğü fazlasıyla karşılar.
VIIA Elementlerinin Bazı Özellikleri
* Elementel halde ve yakın atom çapına sahip diğer atomlarla oluşturduğu bileşiklerde aldığı yarıçap değeri
** İyon yarıçapı 1-
Halojenlerde, genel eğilimden sapmalardan biri de bromda görülür. Grupta aşağıya doğru inildikçe elektron ilgisindeki düşme bromda beklenen ölçüde olmaz. Klor ve bromun elektron ilgisi birbirine yakındır. Bunun nedeni dolu 3d orbitallerindeki elektronların, çekirdeği s ve p elektronları kadar perdelememesidir. Bu nedenle değerlik elektronlarına karşı etkin çekirdek yükü beklenenden büyüktür.