Tel:
Fax:
Email:

www.hayatiboskut.com.tr

















3.4.4.1 VII A Elementleri
Grup VIIA elementleri, doğada halojenürleri halinde bulunur. Kolaylıkla yükseltgenebilen iyod, iyodat bileşikleri halinde bulunur. Klorür, bromür ve iyodürlerin birçoğu suda çözündüklerinden denizlerde ve tuzlu sularda sıkça rastlanır. Fluor için en önemli kaynak olan CaF2 suda çok az çözündüğünden tortul kayalarda bulunur.
Reaksiyon yatkınlıkları yüksek olduğu için halojenler doğada serbest halde bulunmazlar. Anyon olarak bulundukları iyonik bileşikler halindedirler. Bu bileşiklerden element halinde halojenlerin elde edilebilmesi için çok kuvvetli yükseltgen maddeler gerekir. Halojen iyonlarını yükseltgeyebilen maddeler, hem pahalı hem de büyük ölçüde sağlanması güç olan maddelerdir. Bu nedenle yükseltgenme elektrik enerjisinden yararlanılarak yapılır. Örneğin; Klor sodyum klorürün sudaki çözeltisinin elektrolizinden elde edilir.
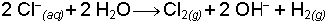
Brom deniz suyundaki Br-

Reaktivitesi çok yüksek olan fluor, sulu çözeltilerinden elde edilemez. Bunun için fluor eritilmiş KF'de çözünmüş HFnin demir katodlu ve grafit anodlu bir elektroliz kabında havasız ve nemsiz ortamda elektrolizinden elde edilir. Halojenlerin hidrojen bileşikleri, uçucu olamayan asitlerin halojenür tuzları ile olan reaksiyonlarından elde edilir.

HBr ve HI de benzer reaksiyonlar ile ele geçer. Ancak bu kez sulfat asidi yerine fosfat asidi kullanılır. Hidrojen halojenürler reaksiyon yatkınlığı yüksek gazlardır, çelik kaplarda saklanırlar. İçinde bulundukları kap ile reaksiyona girmeleri sonucunda böyle kaplarda saklanan hidrojen halojenürlerde safsızlık halinde H2 bulunur.İkinci periyot elementlerindeki özellik farklılığı hidrojen halojenürlerinde de görülür. Elektronegatifliği yüksek ve çapı küçük fluorun oluşturduğu HF molekülleri arasında hidrojen bağlar oluşur. Bu nedenle erime ve kaynama noktaları beklenenden çok daha yüksektir. HCl'den HI'ya inildikçe özelliklerdeki değişimin, periyodik cetvelde beklenen genel eğilime uyduğu görülmektedir.

Klor, brom ve iyot elementlerinin gaz fazları.
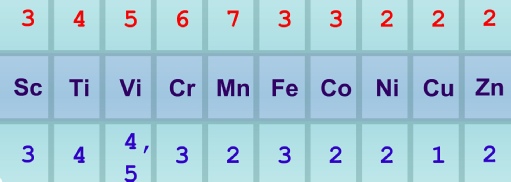
3.4.5 d-
Son yörüngesindeki elektron düzenlenmesi 3d10 4s1 ve 3d10 4s2 olan Bakır ve Çinko aslında geçiş metalleri değildirler. Bununla birlikte, d9 elektron düzenine sahip olan Cu(II) kesinlikle bir geçiş metali iyonudur ve Zn(II) pek çok açıdan dbloğuna benzer.
Geçiş elementleri genellikle serttir ve yüksek erime, kaynama noktalarına ve periyodik sistemde kendilerinden önceki metallere göre daha yüksek buharlaşma ısılarına sahiptir. Bu sertlik ve daha yüksek buharlaşma ısıları muhtemelen metal bağlarında bulunan (delektronlarına ilaveten) dış s elektronlarının bulunması anlamına gelir. Çekirdek yükünün s ve p elektronlarına d elektronlarını daha zayıf engellemesi nedeniyle, geçiş elementlerinin iyonlaşma enerjileri de, alkali ve toprak alkali metallerine göre çok daha yüksektir. Birinci sıradaki, oksidasyon potansiyelleri s–bloğundan daha düşüktür ve böylece elementlerin reaktivitesi göreceli olarak düşüktür.
Eğer geçiş elementleri bileşiklerini tek kelimeyle karakterize etmek gerekirse bu kelime renkli olmalıdır. Hemen hemen tüm bileşikler renklidir ve sulu çözeltilerdeki katyonun rengi, teşhis edebilmek için iyi bir belirteçtir. Örneğin sulu bir çözelti olan Cu(II) mavi, Ni(II) yeşil, Co(II) pembe, Cr(III) menekşe/viole, Mn(II) açık pembe, Fe(III) sarı–kahve ve Zn(II) renksizdir.
Geçiş metalleri katyonlarının çözeltilerinin renkleri katyonun kimyasal çevresinin değişimine karşı çok hassastır. Örneğin Cu(II) nitratın solgun mavi rengi hidroklorik asit ilave edilmesiyle önce yeşile daha sonra sarı-

Farklı oksidasyon basamağındaki krom bileşiklerinin çözeltileri.
3.4.5.1 Geçiş Elementleri
Birinci sıra geçiş elementlerinin çoğu 2+ oksidasyon basamağında bulunsa da bu değerlik her zaman en kararlı hali göstermez. Gerçekten çoğu elementler çeşitli oksidasyon basamağında bulunurlar. Örneğin Mangan, aşağıdaki bileşiklerde de gösterildiği gibi, 2+'dan 7+'ya kadar oksidasyon basamaklarında bulunabilir.
MnO, Mn2O3, MnO2, NaMnO3, K2MnO4, KMnO4
p bloğundakilerin genel oksidasyon basamağı ikili sayılar halinde değiştiği halde, Mangan’ın ve diğer geçiş elementlerinin oksidasyon basamaklarının birer birer değiştiğine dikkat edilmelidir. Şemada 1. sıra geçiş elementlerinin en yüksek oksidasyon basamağı elementin üstünde, sulu çözeltilerindeki en kararlı oksidasyon basamağı elementlerin altında koyu baskılı sayılarla listelenmiştir. Şemada gösterildiği gibi, sulu çözeltideki 2+ iyonu, artan atom sayısı ile en çok rastlanan iyon durumuna gelir ve Mangan’da maksimum oksidasyon sayısı olan 7+'ya erişir.

Vanadyum (V) elementinin çözeltilerdeki türleri resimdeki gibidir. Sarı +5, mavi +4, yeşil +3, mor ise +2 oksidasyon aşamasındaki renkleri göstermektedir.
Verilen bir geçiş ailesi içinde, ağır elementler genelde daha yüksek oksidasyon basamaklarında bulunurlar. Örneğin, kromat iyonu (CrO42–), güçlü bir oksidasyon aracıdır ve bu yüzden kolaylıkla Cr3+ iyonuna dönüşebilir. Bunun yanında krom ailesinin alt üyelerinden benzer bir anyon olan WO42– en kararlı olanıdır. Benzer şekilde, bir metalin en yüksek oksidasyon basamağını oluşturabilen flor, demirle FeF3 bileşiğini verir. Ancak demir ailesinin en ağır üyesiyle de OsF6 'yı verir.
3.4.6 Asal Gazlar
Asal gazlar reaksiyon yeteneği en düşük element grubunu teşkil eder. Yakın zamana kadar asal gazların kimyasal bağ oluşturabileceği tahmin edilmiyordu. Ancak yapısal özellikleri itibarı ile halojen bileşiklerine benzeyen asal gaz bileşikleri elde edilebilmiştir. Bileşikleri elde edilen asal gazlar büyük atomlu kripton, ksenon ve radondur. Bunların içinde en çok bileşik oluşturan ksenondur. Radyoaktif bir gaz olan radonun kimyasal reaksiyonlarının izlenmesi güçtür.
Reaksiyon yatkınlıklarının çok düşük olması ve doğada çok seyreltik olarak bulunmaları nedeniyle asal gazlar XIX. yüzyılın sonlarına kadar bilinmemekteydi. Mendelev de periyodik cetvelinde asal gazlara yer vermemiştir. Asal gazlar atmosferde çok düşük oranlarda bulunur. En yüksek oranda bulunan argon, hacimce % 0.9 orana sahiptir. Bu oran ksenonda 9.10-
Asal gazların kaynama noktaları çok düşüktür. Kaynama noktalarının çok düşük olması atomlar arası çekme kuvvetlerinin çok zayıf olmasından ileri gelir. Bu kuvvetler moleküllerin büyüklüğü ve elektron sayıları ile arttığından grupta aşağı doğru inildikçe asal gazların kaynama noktası yükselir. Bütün elementler içinde en düşük kaynama noktasına sahip olan helyum 4,18oK 'de kaynar. * Ek bilgi için tıklayınız.
Ağır asal gazlar (neon, argon, kripton, zenon) yerçekiminin etkisiyle volkanik kayalarda hapsolurlar; bu sayede günümüzde dahi incelenebilirler. Bu incelemeler sonucunda atmosferin oluşumu hakkında bilgi toplayabiliriz.