Tel:
Fax:
Email:

www.hayatiboskut.com.tr






















2.3.13 Koordinat Sistemi
Dalga mekaniği uygulamalarında bir sistemi, örneğin bir atom, tanımlamak için fonksiyonu kullanılmaktadır. fonksiyonu sistemi oluşturan taneciklerin koordinatlarının bir fonksiyonudur ve değeri taneciklerin uzayda olup olmadıklarını belirler.
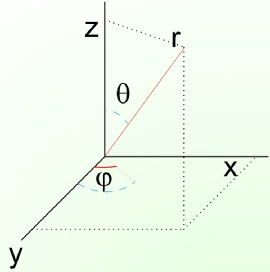
Elektronun potansiyel enerjisi çekirdeğin çekme kuvveti nedeniyle meydana çıkar. Bu çekme, uzaklığa bağlı, ancak yöne bağlı olmadığından sistem, merkezinde çekirdeğin bulunduğu bir küre olarak düşünülebilir. Bu yüzden uzaydaki bir noktanın konumunun kartezyen koordinatlar (x, y, z) yerine küresel polar koordinatlar (r, ) ile tanımlanması tercih edilir. T noktasının konumu için verilen polar koordinatlardan r, noktanın merkeze uzaklığını; r, polar koordinat ekseninin kartezyen z ekseni ile yaptığı açıyı; , r’nin xy düzlemindeki izdüşümünün y ekseni ile yaptığı açıyı gösterir.
Schrödinger teorisinin uygulanabilmesi için klasik mekanikten oldukça farklı kavramlara ihtiyaç vardır. Örneğin momentum hesabında fonksiyonun konumuna göre birinci türevi kinetik enerji hesabında ise ikinci türevi kullanılır. Klasik mekanikteki hız kavramına bu teoride tek başına anlam verilemez. Hız momentum denklemi için yer alan bağımlı değişkendir. Buna göre momentum operatörü ve kinetik enerji operatörü şeklindedir. Üçüncü varsayıma göre toplam enerji operatörü , dalga fonksiyonu ’2 ‘ye uygulandığı zaman sistemin gözlenebilen bir özelliği olan E değeri ele geçmelidir. Schrödinger denklemini çözersek ne elde edeceğiz! Schrödinger eşitliği hidrojen atomuna uygulandığı zaman kuantum sayıları, matematik çözümün bir sonucu olarak görülür. Elektronu enerjileri ile tanımlayan ve atomdaki elektronun genel davranışını veren 3 kuantum sayısı denklemin çözümünden elde edilir.
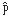


Bohr Atom Modeli'nde kuantum sayılarının varlığını kabul etmek gerekiyordu. Kuantum mekaniğinde ise durum böyle değildir. Kabul edilmesi gereken çok daha genel bir prensip olan Schrödinger eşitliğinin, herhangi bir atomik sistemin davranışını doğru olarak tarif edebildiğidir.
Schrödinger denklemini kullanarak hidrojen atomunun tam olarak çözümü başarılmıştır. Sonuçlar, denel bilgilere bütün ayrıntıları ile uymaktadır. Hidrojen atomuna bu teorik uygulama, kuantum mekaniği için önemli bir sınama olmakla birlikte başka bakımlardan da önemlidir. Bütün atomik sistemlerin en basiti olan hidrojen atomundan türetilen bilgiler, daha karışık atom ve moleküllerdeki elektron davranışlarına model teşkil etmektedir. Örneğin, atomik özelliklerin periyodikliğini ve kimyasal bağın niteliğini anlayabilmek için, hidrojen atomundaki elektronun davranışını tam olarak bilmek gerekir.
2.3.14 Kuantum Sayıları
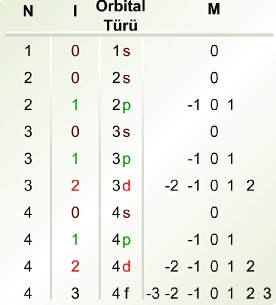
Baş Kuantum sayısı (n) elektronun çekirdekten uzaklığı ile ilgili kuantum sayısıdır ve toplam enerjiye katkısı diğerlerinden fazladır ve bu yüzden baş kuantum sayısı adını alır.Kuantum hipotezinin gereği n baş kuantum sayısı sıfır dışında 1, 2, 3, 4, ... gibi pozitif tamsayıları alır ve orbitalin enerjisi bu tamsayılara karşılık gelir. Schrödinger denkleminin Hidrojen atomu için yapılan çözümünden n sayılarına karşılık gelen kuantalaşmış orbital toplam enerjisi için bulunmuştur.Bu, elektronu tam bir tanecik olarak kabul eden Bohr’un türettiği yörünge enerji denkleminin aynıdır. İlginç olan Bohr’un daha önce tam doğru olmadığını kabul ettiğimiz varsayımlarından türettiği enerji eşitliğin, Schrödinger Denklemi'nin çözümü ile aynı olmasıdır. Bu durum Bohr Modeli'nin Hidrojen atomu gibi basit sistemler için oldukça isabetli yaklaşımları olduğunu göstermektedir.
Açısal-
Manyetik Kuantum Sayısı (m): Üçüncü derecede katkı sağlayan kuantum sayısı ise açısal koordinatına bağlı olan manyetik kuantum sayısı m'dir. Açısal momentumu olan bir elektron bir çemberden geçen elektrik akımı gibi düşünülebilir. Bunun sonucu olarak, bu akımın meydana getireceği bir manyetik alan olmalıdır. Gözlenen manyetizmayı m değeri belirtir. Bu manyetizmanın kaynağı, elektronun açısal momentumu olduğuna göre, m için mümkün değerlerin açısal momentum kuantum sayısı l değerlerine bağlı olması uygundur. Manyetik kuantum sayısı m açısal kuantum sayısı l‘ye bağlı olarak -
Kuantum sayıları kombinasyonu
2.3.15 Olasılık Fonksiyonu ve Orbital
Elektronun çekirdekten uzaklığı ile ilgili kuantum sayısı n polar koordinatlardan r, ikinci derecede katkı sağlayan ve açısal hareketin enerjisini belirten l her iki açısal koordinat ve (n, l, m) = R (n) . (l, m) . (m) şeklinde yazılabilir. R(r) fonksiyonu sadece elektronun merkezden uzaklığını verdiği için radyal kısım, diğer iki fonksiyonun çarpımı ise () . () açısal kısım olarak adlandırılır
Dalga mekaniği prensipleri ışığında Schrödinger teorisi ile ortaya konan ve n, l, m kuantum sayıları ile tanımlanan dalga fonksiyonuna orbital denilmektedir. Orbitalin enerjisi uzaydaki dağılımı ve sayısı n, l ve m değerleri ile belirlidir.
Kuantum sayılarının her grubu farklı tipte bir elektronik hareketi tanımlar. Bu nedenle atomdaki elektronların davranışlarını açıklamada bu sayıların kullanılması kaçınılmazdır. 2 matematik fonksiyonu ile elektronun uzayın herhangi bir noktasındaki bulunma ihtimali belirlenir. Heisenberg Belirsizlik İlkesi'ne göre; bir elektronun konumu için bilebileceğimiz değerler sınırlıdır. Kuantum mekaniği herhangi iki özel noktada elektronun bulunuşunu tam olarak verebilir. Fakat elektronun bu noktaların birinden diğerine nasıl hareket ettiğini söyleyemez. Bu nedenle elektron yörüngesi kavramının modern atom bilgisi içinde geçerliliğinin olmayacağı ortaya çıkmaktadır. Günümüzde kesin belirlenmiş yörünge kavramının yerini elektronun bulunma ihtimalinin yüksek olduğu hacimler almıştır. Bu hacimler (n, l, m) fonksiyonuna göre modellenen orbitallerdir.
Sonuç olarak şunu söyleyebiliriz:
Schrödinger denkleminin çeşitli kuantum sayıları için çözümü yapıldığında elektronun yeri bir noktaya ya da yörünge değil uzayda bir bölge olarak belirlenir. Ancak bu hacimsel bölgenin sınırlandırılmış olduğunu düşünmek yanlıştır, sadece üç boyutlu dalga hareketi yapan elektronun üç boyutlu bu davranışını anlatabilmek için hacim kavramı kullanılabilir.
Dağılımı göster butonuna basarak olasılık dağılımının nasıl olabileceğini gözlemleyiniz
2.3.16 Olasılık Fonksiyonu ve Orbital
Dalga fonksiyonu üç ayrı değişkenin fonksiyonu olduğu için sistem dört boyutludur. Ancak atom gibi kararlı sistemlerde zaman boyutu hesaba katılmaz (Schrödinger Teorisi 1. Varsayım). Üç boyutlu gösterimdeki güçlük nedeni ile fonksiyonun r, ve ‘ye göre değişimi ayrı ayrı incelenir.
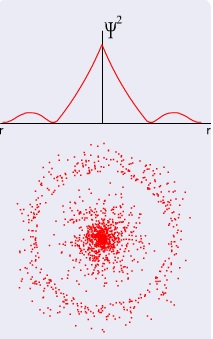
Dalga Fonksiyonunun Radyal Kısmı Radyal dağılım eğrisi ile elektronun bulunma olasılığı hakkında bilgi verir. Burada a0 Hidrojen atomunun birinci yörüngesinin yarıçapı olup “Bohr yarıçapı” denir. [Bohr atom modelinde yörünge yarıçapı hesabı için verilen r = n2h2 / 42 Z m e2 eşitliğinde n = 1 ve z = 1 alınarak a0 = 0,529.10-
1s radyal dağılım eğrisini görmek için tıklayınız.
Dalga fonksiyonunun radyal kısmı elektronun bulunma ihtimalini yöne bağlı olmaksızın sadece çekirdeğe olan uzaklığa göre verir. Yöne veya açılara ( ve ) göre bulunma ihtimalinin nasıl değiştiği ise dalga fonksiyonlarının açısal kısmı ile [ ( ) . ()] çarpımı ile belirlenir.
Dalga fonksiyonlarının açısal kısmının karesi bu fonksiyonların elektronun bulunma ihtimaline katkısını verir. Bu nedenle herhangi bir orbitalin radyal dağılım fonksiyonu ile açısal fonksiyonun karesi çarpıldığında, orbitalin üç boyutlu uzayda elektronu bulundurma ihtimali elde edilir. En yüksek değer 1 kabul edilerek diğer noktalara bağıl değerler verilir. Aynı değeri taşıyan noktaların birleştirilmesi ile yoğunluk haritaları ele geçer. Üç boyutlu uzayda bu eğrilerin yüzeylere karşılık geldiği dikkate alınmalıdır.
Sonuçta; dalga fonksiyonunun radyal kısmı R(r) elektronun çekirdekten itibaren bulunma olasılığını açısal kısmı { ( ) . ()} ise (s orbitali hariç olmak üzere) polar koordinat sistemindeki yönlenmeyi ve söz konusu açılara göre bulunma ihtimaline katkıyı ortaya koyar, dolayısı ile orbitalin şeklini belirler. Baş kuantum sayısı (n) arttıkça bu şeklin değişmediği ancak fonksiyonun radyal kısmının değişeceği için orbital büyüklüğünün arttığı söylenebilir.
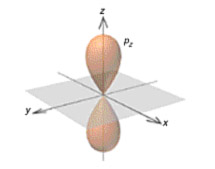
Pz orbitalleri için olasılık görünümleri
Px, Py ve Pz orbitalleri için olasılık görünümleri.