Tel:
Fax:
Email:

www.hayatiboskut.com.tr





















2.3.17 Çok Elektronlu Atomlar
Birden fazla elektron içeren atomlarda Schrödinger denkleminin çözümünü başarmak son derece güç bir işlemdir ve tam çözüm mümkün olmamıştır. Çünkü her elektron için ayrı ayrı üç adet polar koordinat değişkenini (r, , ) kullanabilmek için, çekirdek ile elektron arasında bulunan değişen oranlardaki perdelenmiş çekmeyi ve Coulomb itmesi nedeniyle elektronların birbirlerini her konumda değişen oranlarda etkilemesini dikkate almak gerekir ki, birden fazla elektron için bütün değişkenleri bir arada kullanmak imkânsızdır. Ancak yaklaşık sonuçlara ulaşmak mümkündür.
Bu nedenle; pratik uygulamalar için çok elektronlu atomlar hidrojen atomu için bulunan kuantum sayıları kullanılarak tanımlanır.
Çok elektronlu bir sistemde her elektron kendine özgü n, l, m ve s değerleri ile tarif edilir. Orbitallerin enerji değeri kuantum sayıları ile belirlendiğinden, elektron dizilişinde belirli bir sıra söz konusudur. Bu elektronik düzen için üç kural vardır.
- Klechkowski Kuralı
- Pauli Kuralı
- Hund Kuralı
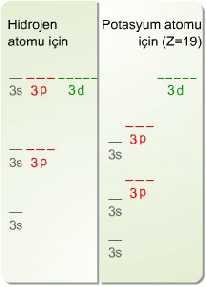
Hidrojen ve potasyum (çok elektronlu atom) atomları için orbital enerjleri diagramı.(Grafikteki enerji seviyeleri ölçekli değildir).
2.3.18 Klechkowski ve Pauli Kuralı
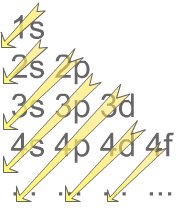
Klechkowski Kuralı
Atoma katılan her elektron n+l toplam en küçük olan orbitale yerleşme eğilimi gösterir. n+l toplamı eşit iki orbital varsa en küçük n değeri olanı tercih eder.
Atom numarası Z = 39’ olan bir atomda orbital tercihi şöyle bulunur:
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f
şeklinde gruplandırılan orbitallerde; 4p dahil olmak üzere 36 elektron yer alır.
Tabloya göre enerji 5s < 4d < 5p < 4f sırasına göre artmaktadır. Bu halde; son üç elektrondan ikisi 5s, bir tanesi 4d orbitaline yerleşecektir. Diziliş,
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1 olarak yazılır.
Pauli Kuralı
1928 yılında Paul Adrien Maurice Dirac tarafından elektronların orbital hareketleri yanında kendi eksenleri etrafında da dönmeleri gerektiği varsayılmış ve bu hareket +1/2 ve –1/2 sayıları ile tanımlanmıştır. Bu sayılar saat yönünde ve aksi yöndeki dönüşleri temsil eder. Pauli bu varsayımı göz önünde bulundurarak;
bir orbitalin aynı ml değerine sahip bölümünde ikiden fazla elektron bulunamayacağını ve bu elektronların ters spinle çiftleşmesi gerektiğini teorik olarak ortaya koymuştur.
Aynı enerji seviyesinde (aynı orbitalde) 2 elektronun Coulomb yasasına aykırı olarak birbirini itmeden nasıl bulunabildiğini tartışınız.
2.3.19 Hund Kuralı
Bu kural atomdaki elektronların maksimum sayıda paralel spin olacak şekilde düzenlenmesini öngörür. Aynı enerjiye sahip bir orbitalde, örneğin 3d elektronlar mümkün olduğu ölçüde tek tek ve aynı spin ile (+½ veya -
Bu kurala göre ; 2 s + 1 ile gösterilen “spin katlılığı” büyük olan düzen daha kararlıdır. Bir orbitalin s değeri çiftleşmemiş elektron sayısı ile ½ değerinin çarpımı kadardır. Anti-
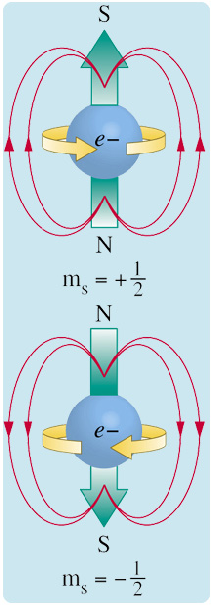
Elektronların ters spin hareketleri.
Birincide spin katlılığı; 2 s + 1 = 2 (1x½) + 1 = 2
ikincide ; 2 s + 1 = 2 (3x½) + 1 = 4 bulunur. O halde ikinci şema kararlı olan, bir başka ifade ile; toplam orbital enerjisinin daha düşük olduğu doğru dizilişi göstermektedir.
Bölüm Özeti
Bu bölümde şu kavramları öğrendik.
- Atom hakkındaki bilgilerin gelişimini takip ederek, günümüz bilgi seviyesini oluşturan temel bilgileri.
- Başta elektron olmak üzere atomik cisimlerin genel davranışını.
- Genel fizik teorilerinin atom için uygulanmasını.
- Kuantum mekaniği temelinde, orbital kavramını.