Tel:
Fax:
Email:

www.hayatiboskut.com.tr





















2.3.1 Thomson Atom Modeli
Thomson ve Milikan deneylerinde; elektronun atomun çok küçük bir kütlesini meydana getirdiği iyonların ve elektronun e/m oranları karşılaştırılarak ispatlanmıştır. Atomlar elektrik bakımdan nötral olduklarından, geri kalan büyük kısım pozitif yük taşımalıdır. Dolayısıyla pozitif yük atomun kütle bakımından büyük kısmını teşkil ediyorsa hacmen de büyük yer işgal etmelidir. Bu düşüncenin doğruluğu, çekirdek ve elektronun yaklaşık aynı yoğunlukta oldukları varsayımı ile mümkün olacaktır. Ayrıca, 1900'lü yılları başlarında elde edilebilen sayısal sonuçlarla, bir atomun hacmi ve boyutları yaklaşık da olsa hesaplanabilmektedir. Örneğin; 1 cm3 hacimde 1 mol atom bulunduğu varsayımından yola çıkılarak, 1 cm3 değeri Avagadro sayısına bölünür ve bir atomun yaklaşık 10-
Böyle varsayımlarla hareket eden J. J. Thomson atom için; 10-
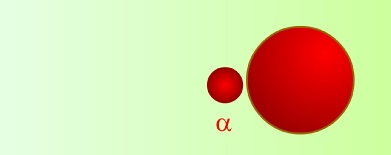
Bir portakal (çekirdek) ve üzerindeki gözenekler(elektronlar) şeklinde düşünülebilecek bu basit model 1911 yılına kadar ilgi görür. Ernest Rutherford’un a tanecikleri ile yaptığı deneyler, Thomson Atom Modeli'ni geçersiz kılmıştır.
2.3.2 Rutherford Atom Modeli
Ernest Rutherford, hızları ve kütlesi bilinen taneciklerini 10-
kaynağında çıkan taneciklerin saçılma sırasında izleyebilecekleri yollar gösterilmiştir. Altın levhaya çarpma sırasında meydana gelebilecek
saçılma olasılıklarından bazıları gösterilmiştir.
Deneylerde; taneciklerinin büyük oranda küçük sapma açıları ile altın levhadan geçtiği görülmüştür. Kütlesi ve hızı daha önceden hesaplanmış pozitif yüklü taneciklerinin kinetik enerjileri çok büyüktür. Bu yüzden küçük açılı sapmaların olabilmesi için metal levhayı meydana getiren atomlarda pozitif yüklü bu taneciklerin rahatlıkla geçebileceği boşluklar olmalıdır. Bu ise atom çekirdeğinin küçük hacimli olması ile mümkündür. Ancak bu şekilde yüksek enerjili tanecikleri elektrostatik kanunlara göre pozitif yüklü çekirdekten daha az etkilenirler. Küçük açılı sapmaların çok oluşu bunların söz konusu edilen bu yoğun (+) yüklü noktalara rastlama ihtimallerinin az oluşu ile açıklanabilir. O halde; pozitif yüklü atom çekirdeği Thomson Atom Modeli'nde belirtilenin aksine elektronlarla arasında boşluklar verecek şekilde atomun merkezinde bulunmalı ve atomdaki bu boşluklar oldukça büyük olmalıdır.


4
Kaynağı
2

-
10 mm Kalınlığında altın lavha
ZnS Ekran
2.3.3 Rutherford Atom Modeli
Rutherford pozitif yüklü çekirdeğin çapını hesaplamak için saçılma deneyindeki verileri kullanılmıştır. Tasarlanan matematik model şöyledir: taneciği 180o lik sapma gösterdiğinde çekirdeğe tam olarak çarpmıştır. Geldiği doğrultuda geri döner.
Böyle bir çarpışmada; taneciği, Coulomb itme potansiyel enerjisi başlangıçtaki kinetik enerjisine eşit olana kadar çekirdeğe yaklaşır. Tanecik çekirdeğe r kadar yaklaştığında kinetik ve potansiyel enerjilerden doğan kuvvetler eşitlenir.
* Rmin değerinin hesaplanması ile ilgili ek bilgi almak için tıklayınız.
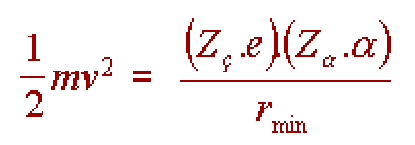
Denklemde; Z, taneciklerinin yükü (2+), m ve v taneciklerinin kütlesi ve hızı, Zç metal levhadaki atom çekirdeklerinin yükü, Rmin taneciğin çekirdeğe yaklaşabildiği en düşük mesafedir.
Deneme ve yapılan hesaplamalar çekirdeğin çapının atom çapından 10.000 kattan daha küçük olduğu sonucunu vermektedir. Gerçekte; Rutherford da bu deneme ve hesaplamalardan sonra kendi adı ile anılan modeli önermiştir:
“Atom merkezde hacmen çok küçük, buna karşılık oldukça yoğun ve bu yüzden hemen hemen atom kütlesine yakın ağırlıkta pozitif yüklü bir çekirdek ile çekirdek etrafında oldukça uzak mesafelerde bulunan elektronlardan ibarettir”
Atoma ait sayısal büyüklüklerin belirlenmesi bakımından önemli bir aşama kaydeden Rutherford Atom Modeli, o güne kadar bilinen fizik ilkelerine ters düşmektedir.
Öncelikle; elektronların hareketsiz olmaları halinde ne kadar uzakta olurlarsa olsunlar elektrostatik çekim kuvveti (Coulomb kuvveti) nedeniyle çekirdek tarafından merkeze çekileceklerdir. Çekirdek etrafında döndükleri, dolayısı ile sahip oldukları merkezkaç kuvvetin elektrostatik çekim kuvvetini dengeleyeceği kabul edildiğinde ise; bu defa Klasik Elektromanyetik Kanun’lara bir aykırılık ortaya çıkmaktadır. Çünkü, bilinen elektromanyetik kurallara göre hareket eden yüklü tanecikler ışıma yapar ve ışıma yapan cisimler de enerji kaybeder. O halde de başlangıçta merkezkaç kuvvet sayesinde karşı konulan elektrostatik çekim kuvveti, hareket eden negatif yüklü elektronun ışıma yapması yüzünden sürekli enerji kaybı sonucunda giderek daha etkili olacak ve elektronların yarıçapı azalan daireler (helis) çizerek çekirdek üzerine düşmelerine yol açacaktır. Bu, atomdaki boşlukların ortadan kalkması, sonuç olarak bütün maddelerin zamanla ve belirli bir hızla büzülmesi demektir. Oysa gerçekte böyle bir büzülme olmamakta ve cisimlerin küçülmesi gözlenmemektedir. Bu noktada Rutherford Atom Modeli'nin “fiziksel gerçekliği” ifade ettiğini söyleyemeyiz.
2.3.4 Bohr Atom Modeli
Rutherford’un teklifinden iki yıl sonra, hem Rutherford’un hem de Max Planck’in öğrencisi olan Niels Bohr, Kuantum Hipotezi'ni kullanan yeni bir model ileri sürmüştür. Bohr Atom Modeli'ni anlamak için temel alınan bilgilerden ve bu bilgilerin ortaya çıkışından özetle bahsetmek gerekir.
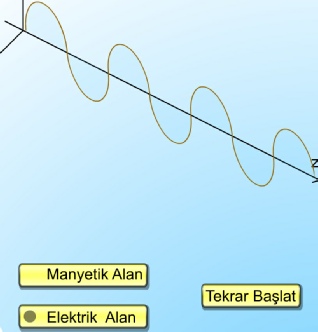
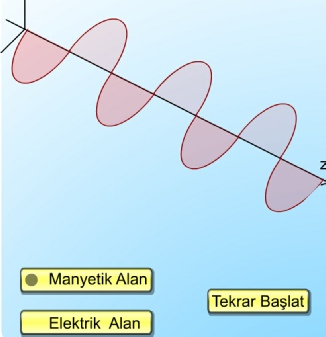
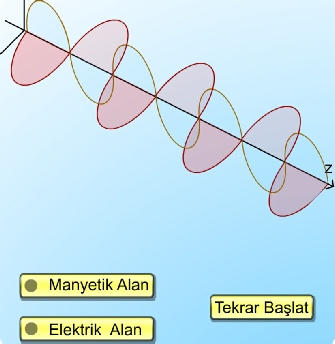
Elektromanyetik Işıma Teorisi
1900'lü yıllardan önce ışığın genel olarak elektromanyetik dalga hareketi olduğu kabul ediliyordu. Çünkü ışıkla yapılan bir çok deneyin sonuçları, ışığın boşlukla yayılan elektrik ve manyetik alan titreşimleri olarak tasarlanması ile açıklanabilmekteydi. Elektromanyetik dalga şeklinde yayılan ışığın, elektrik yükünün salınım hareketi sonucu ortaya çıktığı, salınımın, yükü çevreleyen elektrik alanının periyodik olarak yer değiştirdiği ve dolayısıyla salınım yapan bir manyetik alanın doğduğu kabul edilmişti. Salınım yapan bu elektrik ve manyetik alanların uzayda serbestçe ve ışık hızı ile yayıldıkları gözlemlenebiliyordu.