




Tel:
Fax:
Email:

www.hayatiboskut.com.tr


















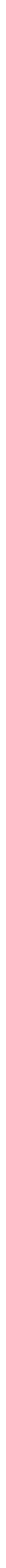



Atomun Yapısı
Bu konu içinde, atomun genel özelliklerini ortaya koyan ve yaklaşık 100 yıl süren denel ve teorik çalışmalar mümkün olduğu ölçüde tarihsel gelişimi içinde verilmiştir. Maddenin temel yapısında yer alan negatif ve pozitif bölümlerin keşfi ve özelliklerinin tanımlanması çalışmaları genel olarak anlatılmaktadır. Atom ile ilgili temel bilgi niteliğinde olan ve elektron davranışını konu alan atom modelleri, ilgili fizik teorileri ile birlikte incelenmektedir. Bu temellerin sadece kimyanın değil tüm fen bilimlerinin veri tabanını oluşturan bilgi birikimleri olduğunu da önemle belirtmek isteriz.
Bölüm Hedefleri
Bu bölümü tamamladığınızda,
Atom hakkındaki bilgilerin gelişimini takip ederek, günümüz bilgi seviyesini oluşturan temel bilgileri öğrenmiş,
Başta elektron olmak üzere atomik cisimlerin genel davranışını öğr enmiş,
Genel fizik teorilerinin atom için uygulanmasını değerlendirmiş,
Kuantum mekaniği temelinde, orbital kavramını incelemiş
olacaksınız.
2.1 Maddenin Elektrik Niteliği ve Faraday Kanunları
Maddenin atom adı verilen temel yapı taşlarından oluştuğunun Dalton Atom Teorisi ile benimsenmesinden sonra tüm çabalar bu defa atomun yapısını araştırmaya yönelmiştir. Atomun yapısının aydınlatılmasında ilk adım, maddenin temel yapısal özelliği olan elektrik niteliğinin bulunmasıdır. Daha sonra ikinci adımda atomların elektronlarla sarılmış çekirdeklerden ibaret olduğu ortaya konmuş ve son aşamada ise; elektron davranışlarının temel ilkeleri belirlenmiştir.Maddenin elektrik niteliği 1833 yılında Faraday’ın elektrik ile ilgili çalışmaları sonucunda netlik kazanmıştır. Bu elektroliz deneylerinin getirdiği yenilikler iki kısımda özetlenebilir.
* Aynı miktarda elektrik akımı her zaman aynı miktarda maddenin elektrotlarda toplanması ve ayrılmasını sağlamaktadır.
* Sabit miktarda elektrik akımı geçişiyle bir elektrotta toplanan ya da çözünen farklı maddelerin miktarları bu maddelerin eşdeğer (ekivalen) tartıları ile doğru orantılıdır.
Faraday elektroliz kanunları olarak bilinen bu denel sonuçların özellikle ikincisi, maddenin elektrik niteliğini ortaya koyması bakımından son derece önemlidir. Maddelerin ekivalen tartılarında eşit sayıda atom olduğu göz önüne alındığında, sabit sayıdaki atomların (belirli ekivalen miktarların) belirli miktarlarda elektrikle birleşmesi Faraday denemelerinde ispatlanmış olmaktadır.
Buna göre; elektrik taneciklerden meydana gelmiş olmalıdır. Belirli sayıda atom yine belirli sayıda elektrik taneciği ile reaksiyona giriyor, şeklinde bir açıklama yapmak mümkündür. Ancak bu durum Faraday tarafından fark edilememiş, 1874’te G.J. Stoney bu denel sonuçlara bu şekilde bir yorum getirerek olası elektrik taneciklerine elektron adını vermiştir. Fakat 1891 yılına kadar elektronun varlığını ve özelliklerini belirleyecek denel sonuçlar elde edilemez. Bu konudaki kesin bilgiler gazların düşük basınçlarda elektrik iletkenlikleri ile ilgili denemelerin yapılmasıyla sağlanmıştır.
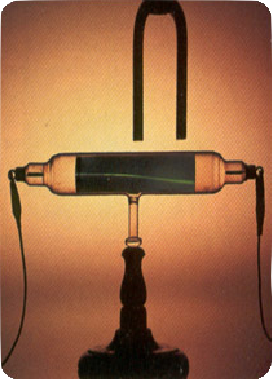
Suyun elektrolizi ile ilgili basit bir deney düzeneği görmektesiniz.
2.2 Thomson ve Milikan Deneyleri
Gazlar normal basınçta elektriği iletmezler. Ancak 0,01 atmosferden daha düşük basınçlarda yüksek elektrik gerilimi altında iyonlaşarak iletken olurlar. Gazın basıncı 10-
Katot ışınları denilen bu enerji akısı ile en verimli denemeleri yapan ve elde ettiği sonuçlarla elektronun varlığını kanıtlayan Joseph John Thomson’dur.
Çeşitli iyonların Cu+2, Fe+2 vb. yük/kütle oranları elektroliz deneylerinden elde edilmekte ve her iyon için doğal olarak farklı değerler bulunmaktaydı. Katot ışınlarını oluşturan parçacıkların yük/kütle oranlarının ölçülmesinin, karakterize edilebilmelerini kolaylaştıracağı düşüncesi ile hareket eden Thomson 1891 yılında başladığı çalışmalarında iki ayrı yöntem kullanarak yük/kütle (e/m) değerlerini tayin etmiştir.
* İlk yöntemde bir elektrot katot ışınları ile bombardıman edilir.
* ikinci yol, manyetik ve elektrik alanların katot ışınlarını birlikte etkilemesi ile gerçekleştirilir.
Katot ışınlarının e/m oranının önemi, çeşitli iyonların elektroliz deneylerinden elde edilen e/m oranları ile karşılaştırıldıkları zaman meydana çıkar.
Katot ışınlarının yük/kütle oranları herhangi bir iyonunkinin 1000 katından fazladır. Bundan başka, çeşitli iyonların yük/kütle (e/m) oranları farklı olduğu halde katot ışınlarının e/m değeri sabit olup deşarj tübünde kullanılan gazın cinsine bağlı değildir. Elde edilen sayısal sonuçların gazın cinsine, kullanılan tübün şekline ve diğer malzemenin niteliğine bağlı olmayışı Thomson tarafından şu şekilde değerlendirilir:
"Katot ışınları elektrik ve manyetik alanda negatif yüklü tanecikler gibi saparlar. Her gaz için aynı sonuçların elde edilmesi bu negatif taneciklerin elektriklenmiş bir çeşit atom (iyon) olmadığını gösterir. Bunlar, her maddede bulunan genel bir parçacık olmalıdır."
Thomson’un iki yolla hesapladığı e/m değeri günümüzde ileri teknoloji şartlarında bulunanlara çok yakındır. Kabul edilen değer 1,76.108 coulomb/gram veya 5,27.1017 esb/g şeklindedir.
2.2.1 Milikan Deneyi
Elektronun bir tanecik olarak karakterizasyonu Robert Alan Milikan tarafından yapılan deney ile gerçekleşmiştir. Simülasyonda gösterilen düzenekte yağ damlacıkları bir pulvarizatör yardımıyla atomize edilir. Bir X ışını kaynağı kullanılarak odacıkta bulunan gaz (veya hava) iyonlaştırılarak damlacıkların değişen oranlarda elektriklenmesi sağlanır. Bu yolla elde edilen yüklü yağ damlacıkları elektrik alan uygulanmadığı zaman iki kuvvetin etkisi altındadır:
1-
2-
Bu iki kuvvet ters vektörlerdir. Serbest düşme hareketi yapan damlacık bir süre sonra, sabit bir hızla hareket edecektir. Hız, dereceli mikroskop yardımıyla birim zamanda alınan yol ölçülerek hesaplanabilir. Eğer q yükünü taşıyan aynı damla E alanının etkisinde bırakılırsa, onu yukarıya doğru hareket ettiren kuvvet q.E olur. Yerçekimi etkisi yüzünden damlayı etkileyen net kuvvet mg’dir. Sonuç olarak doğru hızı veren eşitlik; son halini alır.
Milikan q’nun daima 4.8 10–10 esb veya bu değerin tam katları olduğunu bulmuştur. Bu sonuç elektriğin taneciklerden oluştuğunu ve temel yük biriminin 4.8 10–10 esb olduğunu gösterir. Ayrıca, Thomson’un bulduğu oran kullanılarak elektronun kütlesi (e/m= 5.27 1017 esb ise; 4.8 10–10/ = 5.27 1017 eşitliğinden m= 9.1 10–28 gram) hesaplanabilir.
2.3 Atom Modelleri
Elektronun bir tanecik olarak tanımlanması ve bu negatif taneciğin her atomda bulunması gereken bir bölüm olduğunun anlaşılması, atomun yapısı hakkında hızla yeni fikirlerin ortaya çıkmasına neden olmuştur.
Atom modellerinin tasarlanmasında temel yaklaşım elektronun atomdaki yerinin ve davranış biçiminin belirlenmesidir. Bunun nedeni; maddelerin kimyasal ve bir çok fiziksel özelliğinin sorumlusu olan elektronun anlaşılmasıyla madde özelliklerinin de açıklanabileceğidir. Örneğin kimyasal bağı anlamak için bu oluşumda baş roldeki elektronun doğasını bilmek gerekmektedir.

Grafitteki Karbon Atomlarının Görünümü

Bölüm -