Tel:
Fax:
Email:

www.hayatiboskut.com.tr


















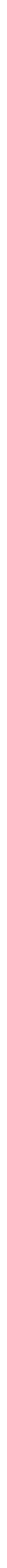



1.3.6 Avagadro Kuralı ve Mol Kavramı
1811 yılında Amadeo Avagadro gazların temel yapı ünitesinin başka ifade ile; o gazın özelliğini taşıyan en küçük birimin atom değil atom grupları olabileceğini öne sürerek gaz reaksiyonlarındaki bu yanlış yorumlardan kaynaklanan çelişkiyi açıklayabilmiştir.
Avagadro’ya göre; gazlar basit yollarla bölünemeyen atom gruplarından oluşmaktadır ve reaksiyonlarda bu grupların diziliş ve bağlanma şekilleri (Dalton atom teorisinin üçüncü hipotezinde öngörüldüğü gibi) değişmektedir. Avagadro’nun açıklaması bütün maddelerin temel yapı taşının atom olduğu gerçeğini değiştirmez. Sadece bir kısım maddelerin molekül denilen yapı birimlerinden meydana geldiğini anlatır.
Avagadro Gay-
“Madem ki gazlar basit hacim oranlarında birleşiyorlar, o halde bütün gazların eşit hacimlerinde aynı sayıda molekül olmalıdır.”
hipotezini önermiştir. Bu daha sonraki yıllarda belirlenen Avagadro Sayısı olan 6,023.1023 büyüklüğünün anlatımıdır ve Avagadro Kuralı olarak bilinir.
1.3.7 Mol Kavramı
Avagadro sayısı ile karakterize edilen standart büyüklük, madde miktarını belirtmede temel olmuştur. Bu sayının katları ve kesirleri mol, mol-
Atom-
mol-
Mol kavramı geneldir, her tür saf element ve bileşiğin miktarını belirtmede yararlanılabilir. Mol bir temel büyüklük olarak; 1960 yılında toplanan uluslararası Ölçüler ve Tartılar Konferansı’nda kabul edilen ve SI (System International) adı ile bilinen yeni birim sisteminde yer alır.
Bu açıklama; Dalton Atom Teorisi’nin yetersiz yanını ortaya çıkarmış ve N2, O2, H2, CO, CO2 gibi çok atomlu gazların özelliklerinin daha iyi anlaşılmasını sağlamıştır. Bu hipotez deneysel sonuçlara dayanmaz; ancak Dalton Atom Teorisi ile açıklanamayan gaz reaksiyonlarının açıklanmasını sağlamıştır. Daha sonra Gazların Kinetik Teorisi geliştirildiğinde, bu hipotez de deneysel olarak ispatlanmıştır.
1.4 Ölçme ve Ölçü Büyüklükleri
Bu bölüm altında şu alt başlıkları inceleyeceksiniz.
Ölçme ve Birim Sistemleri
Birim Sistemleri
SI Birimler Sistemi
SI Birim Çarpanları
1.4.1 Ölçme ve Birim Sistemleri
Sonuçları değerlendirilebilir denemeleri yapabilmek, ölçme ile mümkündür. Ölçme, genel anlamda seçilen standart büyüklüğü, bir başka büyüklük ile mukayese etmektir. Standart büyüklük metre alındığında, ölçülecek bir mesafe için 12 metre denmesi ile; söz konusu uzunlukta 12 adet standart büyüklüğün olduğu anlatılmak istenir. Şüphesiz seçilen standart büyüklüklerin değişmez değerler alması en önemli özelliktir. Bilimsel çalışmaların anlatılması ve anlaşılması, ölçmede kullanılan birim büyüklüklerin herkes tarafından kabul edilebilir olduğu durumlarda mümkündür.Deneysel verilerin kolay ve sağlıklı değerlendirilmesi için, temel ve türetilmiş büyüklüklerin bir disiplin içinde kullanılması önemli faydalar sağlar. Özellikle eğitimde ve bilimsel iletişimde bu bir gereklilik halini alır.
1.4.3 SI Birimler Sistemi
1960 yılında toplanan uluslararası Ölçüler ve Tartılar Konferansı’nda SI (System International) adı ile bilinen yeni birim sistemi benimsenmiş ve kullanımın yaygınlaşması için tavsiye kararı alınmıştır. Bilimsel ve teknolojik çalışmalarda tek birim sisteminin kullanılması ile elde edilecek birliğin ve düzenliliğin yararı açıktır. Kimyacıların çok kullandığı bir birim olan kalorinin (SI sisteminde enerji birimi joule’dür) kullanılması, Tartılar ve Ölçüler Genel Konferansı tarafından istenmemektedir. Fakat, günümüze kadar bütün termodinamik değerler kalori (veya kilokalori) cinsinden verildiğinden her iki birimi de kullanma alışkanlığını edinmek gerekir. Diğer taraftan, litre (L = 1 dm3), Angström (1A = 10-
1.4.4 SI Birim Çarpanları
SI birim çarpanlarını aşağıdaki tabloda görmektesiniz.
SI Birimler Sisteminin Temel Büyüklükleri

Bölüm Özeti
Bu bölümde şu kavramları öğrendik.
Madde ve enerji hakkındaki bilgileri
Element, bileşik ve karışımları ayırt etmeyi
Karışımların ayrılmasında kullanılan genel ayırma yöntemleri
Temel kimya yasalarının madde bilgisine getirdiği yenilikleri
Standart ölçü büyüklüklerini sayabileceksiniz.

1.4.2 Birim Sistemleri
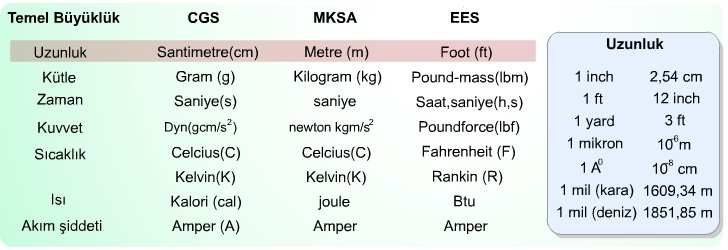
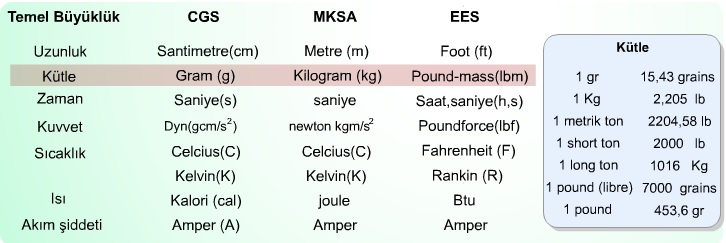
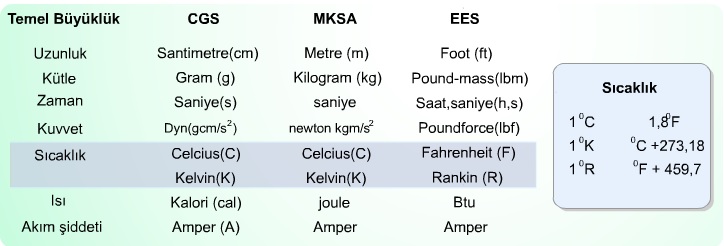
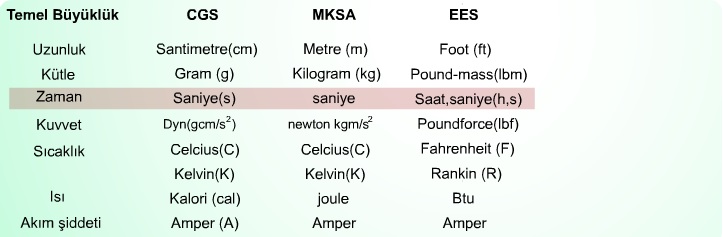
Temel bilimler ve mühendislik uygulamalarında tercih edilen başlıca üç birim sistemi (CGS, MKSA ve EES) ortaya çıkmıştır. İngiliz ve bağlı devletleri tarafından kabul edilen ölçü birim sistemi olan EES ile daha genel olan CGS birim sistemlerinin karşılaştırılması tabloda verildiği gibidir.

Uzunluk Birimi











Kütle birimi











Kuvvet Birimi










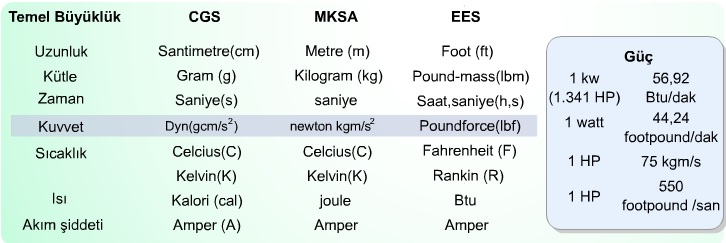











Sıcaklık Birimi











Zaman Birimi











Isı Birimi












Akım Şiddeti