Tel:
Fax:
Email:

www.hayatiboskut.com.tr





















1.2.1 Madde-
Klasik fizik, Newton yasalarının belirlediği çerçeve içinde; kütle, hız ve ivme gibi büyüklüklerin arasındaki ilişkileri konu alır ve potansiyel enerji, kinetik enerji kavramlarını ortaya koyar. Kısaca klasik fizikte madde sadece kütle olarak düşünülür ve kütlenin hareketinin ya da pozisyonunun enerjitik fonksiyonu değerlendirilir. Albert Einstein, E = mc2 eşitliğinde ifadesini bulan rölativite teorisi ile madde ve enerji arasındaki ilişkiye yeni bir boyut kazandırmıştır. Einstein’a göre maddenin enerjiye, enerjinin de maddeye dönüşümü mümkündür ve bu, bilinen kriterler göz önüne alındığında yapısal değişim anlamına gelir.Daha genel yaklaşım; her maddenin enerji eşdeğeri, her birim enerjinin de madde eşdeğeri olduğu, şeklindedir. Ayrıca, kuantum mekaniğinde olduğu gibi özellikle mikro sistemlerde madde ve enerji olgularını aynı anda birlikte düşünmek ve değerlendirmek mümkündür.Kimyasal reaksiyonlarda; madde eşdeğeri olarak ortaya çıkan enerji çok küçük olduğu için kütle değişimi gözlenemez ölçülerdedir. Kütle değişiminin ölçülebildiği reaksiyonlar, çekirdek birleşmeleri ve bölünmeleridir. Bununla beraber her türlü kütle-
1.2.2 Enerji ve Enerjinin Korunumu İlkesi
Enerji
Termodinamik prensipler dikkate alındığında enerji, iş yapabilme gücü olarak tarif edilir. Her türlü enerji iş yapar veya geniş anlamda her enerjinin iş karşılığı vardır. İş ise bir kuvvetin aldığı yol ya da kuvvet vektörünün değeri olarak tarif edilebilir. Örneğin 1 Newton değerindeki kuvvet 1 metre yol aldığında yapılan iş;
1 N x 1 m = (kg m / s2) (1 m) = 9 .103 joule olacaktır.
Enerjinin korunumu ilkesi:
Enerji çeşitli şekillerde ortaya çıkabilir ve bir sistemde birden fazla enerji çeşidi bulunabilir: mekanik, ısı, ışık, manyetik vb.“Bir sistemde bulunan enerjiler birbirlerine dönüşebilir, ancak sistemin toplam enerji değeri değişmez.” Bu, enerjinin korunumu ilkesidir.
1.3 Kimyanın Temel Yasaları
Maddelerin genel kimyasal özelliklerini açıklayabilen ve deneysel gözlemlerle ispatlanan sistematik düşünce ürünü buluşlar 18. yüzyılın ikinci yarısından itibaren ortaya çıkmaya başlar. Maddenin kimya bakımından en basit davranışlarını konu alan bu açıklamalar temel kimya yasaları olarak bilinir.
- Kütlenin Korunumu İlkesi
- Sabit Oranlar Yasası
- Dalton Atom Teorisi
- Katlı Oranlar Yasası
Gay-
Avagadro Kuralı ve Mol Kavramı.
1.3.1 Kütlenin Korunumu İlkesi
Kimyanın temel yasalarından ilki Antoine Laurent Lavoisier tarafından ortaya konan kütlenin korunumu ilkesidir. Lavoisier gerçekleştirdiği kimyasal reaksiyonlarla ölçülü sonuçlar elde eden, dolayısıyla gerçek anlamda ilk deney verilerini elde eden öncü bilim adamlarından biridir. Reaksiyonları gerçekleştirdiği deneylerde, giren maddelerin toplam kütlesi ile ürünlerin toplam kütlesinin birbirine eşit olduğunu sayısal sonuçlarla saptamıştır.
Kütlenin korunumu ilkesi
“Reaksiyona giren maddelerin toplam kütlesi reaksiyondan çıkan ürünlerin toplam kütlesine eşittir.”
şeklinde ifade edilir.
Ancak;
“Madde yoktan var edilemez ve kaybedilemez.” halinde söylenerek bütün bilim dalları için genelleştirilir ve felsefi bir anlam yüklenir.
1.3.2 Sabit Oranlar Yasası
Sabit oranlar ifadesi ile, bir bileşiği oluşturan elementlerin kütleleri arasında değişmeyen bir oranın bulunduğu anlatılmak istenir. Örneğin; potasyum klorür’de bu oran 39/35,5 olup, bu madde için sabit bir değerdir ve bu bileşiğin yapı özelliğini teşkil eder.
Sabit Oranlar Yasası, elementlerin birbirleriyle rasgele her oranda değil, sadece belirli kütle oranlarında birleşebileceği pratik sonucunu ortaya çıkarmıştır.
Diğer örnekler;
H2O’da H / O = 2 / 18 = 1 / 8
H2S ‘de H / S = 2 / 32 = 1 / 16
Na2S ‘de Na / S = 46 / 32 = 23 /16
şeklinde verilebilir.
1.3.3 Dalton Atom Teorisi
Dalton maddenin yapısını atom teorisi ile izah edebildiği için modern kimyanın gelişmesine en önemli katkıları yapan kişiler arasındadır.
Dalton’un atom teorisi, Lavoisier tarafından bulunan Kütlenin Korunumu İlkesi ile Richter ve Proust tarafından ispatlanan Sabit Oranlar Yasası’na ve aynı zamanda da deneysel gözlemlere dayanılarak teklif edilmiştir. Dalton Atom Teorisi, 3 hipotezden oluşmaktadır.
1. Madde, görünmeyen ve atom denilen parçacıklardan ibarettir.
2. Bir elementin bütün atomları aynı özellikleri taşır ve diğer element atomlarından farklıdır.
3. Kimyasal reaksiyonlar, atomların düzenlenme (diziliş) türünün ve birleşme şeklinin değişmesi ile meydana gelir.
Dalton’un bu hipotezleri, deneysel sonuçların açıklanabilmesi ve bilinmeyen kuralların tahmin edilmesi bakımından oldukça başarılıdır.

Potasyum klorür'deki atom dizilişini görmektesiniz.
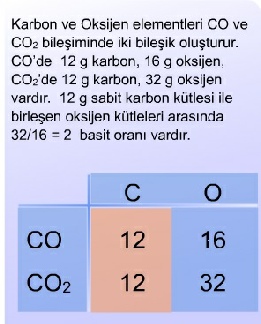
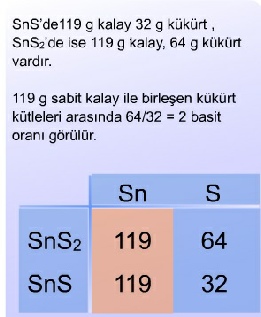
1.3.4 Katlı Oranlar Yasası
Dalton teorisi (1908), katlı oranlar yasasına temel teşkil eder. Buna göre;
“Aynı iki element birden fazla bileşik oluşturabiliyorsa, bunlardan birinin sabit kütlesiyle birleşen diğer elementin artan kütleleri arasında, tam sayılarla yazılabilen basit bir oran vardır.”
Bu sonuçlar atom teorisine uygundur. Çünkü SnS’de 1 adet kalay atomu ve 1 adet kükürt atomu, SnS2’de de 1 kalay atomu ile 2 kükürt atomu vardır. Elementler atom birimleri halinde birleşmektedirler.
1.3.5 Gay-
Joseph Gay-
Örneğin 1 litre Cl2 + 1 litre H2 karışımından 2 litre HCl gazı meydana gelir. Fazla alınan gaz reaksiyona girmemektedir. O halde Sabit Oranlar Yasası’nda, kütle oranlarında olduğu gibi:
“Birbirleriyle reaksiyona giren gazlarla oluşan gaz bileşiklerin hacimleri arasında, küçük sayılarla ifade edilebilir basit oranlar vardır.”
Bu ifade Gay-
Örneğin; 2H2 + O2 2H2O reaksiyonunda gazlar arasında H/O = 2/1 = 2 basit oranı vardır.
Bu deneysel sonuçlar Gay-
 Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Gerİ
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Gerİ