




Tel:
Fax:
Email:

www.hayatiboskut.com.tr
















Farklı maddelerin katı, sıvı ve gaz hallerini görmektesiniz.

1.1.4 Maddenin Halleri
Madde katı, sıvı ve gaz olmak üzere üç halde bulunur. Bu haller, yeryüzünde rastladığımız olağan hallerdir. Fakat uzayda, bu üç hal, pek sık rastlanılan haller değildir. Uzayda, madde plazma halinde bulunur. Plazma, atomların pozitif çekirdekler halinde bulunduğu ve serbest elektronlar içeren bir karışımdır. İyonlaşma, birkaç bin veya birkaç milyar oC sıcaklık ile sağlanır ve iyonlaşma sonucu, belirgin fiziksel ve kimyasal özellikler oluşur. Örneğin, plazmada elektriksel iletkenlik yüksek olduğu gibi, akışkan plazma bir elektrik akımı yaratır ve manyetik alandan etkilenir. Bu özellikler, nükleer enerji üretiminde önemlidir ve kontrollü çekirdek füzyonu ile elektrik enerjisi elde edilmesi, plazma fiziği alanında araştırma yapan kişilerin en önemli hedeflerinden biridir.
1.1.5 Element, Bileşik, Karışım

Üstteki resimde element, bileşik ve karışımların atomik ölçekte nasıl görüneceği gösterilmiştir.
1.1.6 Ayırma ve Saflaştırma Yöntemleri
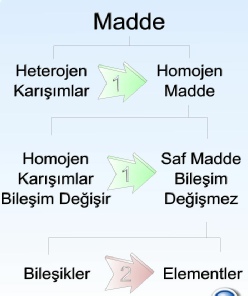
Doğada ve laboratuvar şartlarında birden fazla madde çeşitli tiplerde karışımlar halinde bulunabilir. Kimya laboratuvarlarında ve endüstriyel uygulamalarda, karışımlar gerektiğinde kendilerini oluşturan bileşenlere ayrılmak istenir. İstenilen saf element ve saf bileşikleri elde etmek için bir veya birkaç ayırma yöntemi seçilerek uygulanır. Ayırma yönteminin seçimi karışımın niteliği ile karışımı oluşturan maddelerin bilinen ya da tahmin edilebilen özellikleri göz önünde bulundurularak yapılır.Element, bileşik ve karışımların sınıflandırılması ve bunların ayrılması şekilde gösterilmiştir. Kimya laboratuvarlarında sıkça uygulanan fiziksel ayırma yöntemlerinden Ölçme ve Birim Sistemleri konularında özetle bahsedilecektir. Kimyasal ayırma yöntemleri daha çok kimya araştırmaları için kullanılan ve ayrıntılı kimya bilgisini gerektiren süreçler olduğu için bu konu kapsamına alınmamıştır.Karışımın heterojen veya homojen olmasına göre farklı türde uygulamalar vardır. Bu bakımdan fiziksel ayırma işlemlerini karışımın niteliğine göre
heterojen karışımların ayrılması ve
homojen karışımların ayrılması
adı altında iki kısımda ele almak gerekmektedir.
1 numaralı ok fiziksel ayrıştırma yöntemlerini, 2 numaralı ok ise kimyasal ayrıştırma yöntemlerini temsil etmektedir.
1.1.6.1 Ayırma ve Saflaştırma Yöntemleri: Heterojen Karışımların Ayrılması
Kimya laboratuvarlarında sıkça uygulanan fiziksel ayırma yöntemlerinden heterojen karışımlarla ilgili olanlar şunlardır:
1.1.6.2 Ayırma ve Saflaştırma Yöntemleri: Homojen Karışımların Ayrılması
Kimya laboratuvarlarında sıkça uygulanan fiziksel ayırma yöntemlerinden homojen karışımlarla ilgili olanlar şunlardır:
1.2 Enerji
Bu bölüm altında şu alt başlıkları inceleyeceksiniz.
- Madde-
Enerji İlişkisi - Enerji ve Enerjinin Korunumu İlkesi




Homojen : Madde, tek bir fazdan ibaretse homojen madde olarak adlandırılır. Homojen karışımlar tek fazdan ibarettir ve gaz sıvı ve katı fazda olabilir; örneğin hava, şekerlerin sudaki çözeltisi ve metal alaşımları homojen karışımlardır.










Hetetojen : Madde, birden fazla faz içeriyorsa heterojen madde olarak adlandırılır. Heterojen karışımlar her faz kendine ait fiziksel ve kimyasal özellikleri taşır Örneğin; su-




















Element : element, basit kimyasal yollarla daha başka maddelere ayrılmayan saf maddelere verilen addır. Örneğin: hidrojen ve oksijen elementtir. Saf maddeler erime noktası, yoğunluk, kaynama noktası, kırılma indisi gibi intensif özellikler ile karakterize edilirler. Elementler saf halde ya da karışımlar halinde bulunabilir.
Bileşik : Bileşik, elementlerin belli ve sabit oranlarda birleşmesiyle oluşan saf maddelerdir. Örneğin: hidrojen ve oksijen elementlerin meydana getirdiği su bileşiktir. Bileşikler saf halde ya da karışımlar halinde bulunabilir.













Ayıklama: Şekil ve boyut bakımından farklı cisimlerin meydana getirdiği karışımların ayrılmasında kullanılır. Örneğin; hurda kağıt ve metal çöplerden oluşan bir karışımın ayrılmasında ayıklama işlemi uygulanabilir.










Aktarma ( Dekantasyon): Sıvı ve katı fazlardan oluşan karışımlara uygulanır. Katı fazın yoğunluğu daha büyükse kabın dibine çöker. Sıvı faz katı fazın aldığı form bozulmaksızın aktarılır. Su ve kumun ayrılmasında bu yöntem kullanılır.





















Süzme (filtrasyon): Katı-
Çöktürme (Sedimantasyon): Büyük hacimlerde katı faz miktarının az olduğu hallerde veya uzun sürelerde ayrılabilen katı-




















Yüzdürme (Flotasyon): Katı karışımlarda ayrılması istenen bileşen kendisinden daha yoğun sıvı fazla karıştırılır. Ayrılması istenen az yoğun madde, daha yoğun olan sıvı fazın yüzeyinde toplanır. Atık olarak kabul edilen kısım ise dipte toplanır. Yüzen madde sürüklenerek sıvı yüzeyinden alınır.
Dializ: Farklı molekül büyüklüğüne sahip çözünen maddelerin bulunduğu çözeltilere uygulanır. Yüzeyinde küçük çaplı delikçiler (gözenek) bulunan yarı-












Destilasyon: Karışımı meydana getiren ve daha uçucu bileşenin buharlaştırılarak sistemden uzaklaştırılmasıyla yapılır. Kaynama noktaları arasında yeterli derecede fark bulunan iki sıvının meydana getirdiği homojen bir karışım (ör. Su ve etilalkol) sıtıldığında kaynama noktası düşük olan sıvı önce buharlaşır ve sistemden ayrılır;diğer sıvı sistemde kalarak ayrıştırılmış olur. Bu işlem ikiden fazla bileşenli sistemlere de uygulanabilir. Kaynama noktaları arasında az fark varsa işlem kademeli olarak uygulanır ve reftifikasyon adını alır.









Kristalizasyon: Bütün anorganik ve organik maddelerin çözünürlükleri sıcaklık yükseldikçe artar. Bir çözeltinin sıcaklığı artırılır ve bir miktar daha çözünen madde ilave edilirse, sıcaklıkta doymuş çözelti elde edilir. Soğumayla, sonradan ilave edilen miktar,homojen çözelti ortamından ayrılarak katı faz oluşturu. Bu şekilde kristalleşen madde, kendine özgü bir kristal yapısı aldığı için çözeltidebulunan safsızlıkları, kirlilikleri ve diğer bileşenleri bünyesinde barındıramaz.
Bu yüzden kristalizasyon bir ayırma yöntemi olmasına ragmen genelde saflaştırma amacı için uygulanır. Her hangi bir çözeltide fazla çözünmüş madde varsa, bunların çözünürlük derecelerine göre sırayla kristallenmeleri mümkündür. Bu işlem fraksiyonlu kristalizasyon denir.



















Ekstraksiyon: Homojen karışımlarda bulunan bileşenlerden birinin uygun bir çözücü ile alınmasıdır. Örneğin çözünebilen kahve imalinde, kahve çekirdekleri çeşitli çözücülerle ekstrakte edilmekte, kafein ve diğer aromalı bileşenler çözücü fazına geçerek odunsu kısmından ayrılmaktadır. İşlemde dikkat edilecek husus çözücünün seçimidir.
Süblimasyon: Bazı maddelerin sıvı (likid) hali yoktur. İyot,naftalin, nişadır (amonyum klorür) gibi maddeler ısıtıldıklarında sıvılaşmadan doğrudan gaz fazına geçerler. Aynı şekilde bu maddelerin buharları sogutulursa sıvı hali atlayarak katılaşır. Çift yönlü bu işlem süblimasyon adını alır ve ayırmanın yanı sıra saflaştırma yöntemi olarak da kullanılır. Destilasyonda olduğu gibi süblimasyon sıcaklıkları arasında yeter derecede fark bulunan karışımlardaki süblime olabilen maddeyi ayırmak için kullanılır.




















Elektroforez: Dializ işlemine benzer yarı geçirgen zara ilave olarak çözeltiye elektrotlar yardımıyla elektirik gerilimi uygulanır. Yarı geçirgen zar anot ve katot bölmeleri arasındadır. Bu şekilde (-
Kromatografi: Maddelerin bir ortamdaki absorpisyon yetenekleri farkının degerlendirmesi temeline dayanır. Kullanılan ortamlara ve uygulama tekniklerine göre:
a-
kromatografisi olmak üzere başlıca dört gruba ayrılır. Çözeltide bulunan maddeler, örneğin, kiselgurdan hazırlanmış ince tabaka üzerine bırakılırsa, bileşenler tabaka üzerinde absorpsiyon yeteneklerinin derecesine bağlı olarak zamanla farklı şekillerde yayılırlar. Farklı bölgelere yayılan saf maddeler kiselgur ile birlikte toplanır.madde uygun bir çözücü kullanılarak kiselgurdan ekstraksiyon ile ayrılır.









