






















13.2.2 Standart Elektrod Potansiyelleri
Her metal ve bu metalin iyonlarından ibaret elektrod sisteminin standart gerilimi vardır. Standart potansiyeller hidrojen elektrod potansiyeli sıfır kabul edilerek tayin edilmiştir.
Örnekler:
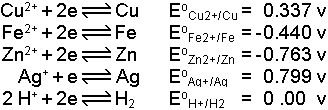
Gösterilen Eo değerleri redüksiyon potansiyeli (indirgeme potansiyeli) adını alır ve H+/H2 elektrodu için sıfır olan Eo değerinin sağında ve solunda olmak üzere sıralanmışlardır. Reaksiyonlar oksidasyon şeklinde yazılırsa Eo işaret değiştirir. Bu halde oksidasyon potansiyeli (yükseltgeme potansiyeli) söz konusudur
13.2.3 Gerilim Sırası
Kimyasal yapı birimlerinin standart elektrod potansiyeli hidrojen elektrod potansiyeli 0.00 volt referans alınarak ölçülmektedir. Örnek; aşağıdaki sıra metallerin redüksiyon potansiyellerinin kısaltılmış sırasıdır. Bu gibi dizilişlere gerilim sırası denmektedir.
Ametaller ve birçok organik bileşik için de bu tür dizilişler mevcuttur. Bu sırada Eo negatif değer alan elementler iyon haline geçme eğilimi olan veya başka bir ifadeyle indirgen olanlardır. Hidrojenin solundaki bütün elementlerin standart redüksiyon potansiyelleri negatiftir. Sağ tarafta olanlar ise elementel hali tercih ederler, bu yüzden yükseltgendirler. Bunlara asal elementler de denir.İki elektrod arasında karşılıklı olarak indirgenme ve yükseltgenmenin olduğu açıkça görülür. Kısaca, redüksiyon ve oksidasyon kelimelerinin ilk heceleri birleştirilerek redoks olarak tanımlanan böyle kimyasal dengeler pillerin temelini oluşturur.
13.2.4 Elektrokimyasal Piller
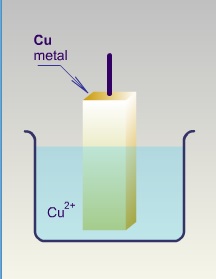
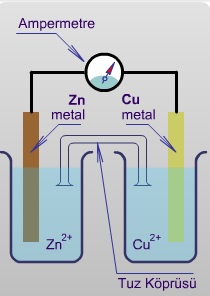
Aralarında potansiyel farkı bulunan iki elektrod iletken bir bağlantı ile birleştirildiğinde anod ve katod reaksiyonlarının meydana getirdiği dinamik sisteme elektrokimyasal pil denir.Örnek olmak üzere Cu-Zn pilinin yapısını ve işleyişini görelim:
İki elementin indirgenme potansiyelleri
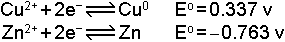
olduğuna göre pilde meydana gelen gerilim farkı
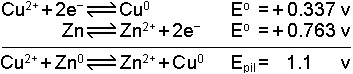
bulunur.
Anod reaksiyonu oksidasyon, katod reaksiyonu redüksiyondur. Bu tür pillerde oksidasyon anodda redüksiyon katodda meydana gelir. Böyle bir pilin şeması

şeklinde gösterilir. (-) işareti elektron üreten (oksidasyonun olduğu) elektrodu (anodu) belirtir.
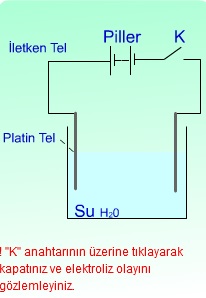
13.3 Elektroliz
Böyle bir pilde anod ve katodda meydana gelen reaksiyonlar temelde kimyasal değişmelerdir. Cu2+ iyonun Cu metaline dönüşmesi ya da Zn metalinin Zn2+ iyonu vermesi net elektron alışverişi ile meydana gelir. Elektronların bu transferi Bölüm 2'de görüldüğü gibi ekivalen tartı (2. Faraday yasası) kavramını ortaya çıkarır.Elektrodlarda ayrılan ya da biriken madde miktarları geçen akım miktarı ile orantılıdır ve bu Faraday tarafından bulunan elektroliz yasasının birincisidir.
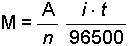
Denklemde; A: atom tartısı, n: reaksiyondaki elektron sayısı, i: Amper olarak akım şiddeti, t: zaman (saniye)'dir.
Suyun elektrolizi ile ilgili basit bir deney düzeneği görmektesiniz.
13.4 Redoks Sistemlerin Potansiyeli ve Nernst Bağıntısı
Bir pilde kendiliğinden olan bir reaksiyon elektrik enerjisi verir. Pile dışarıdan elektrik akımı verilerek reaksiyon tersine çevrilebiliyorsa böyle pillere tersinir (reversibl) pil denir. Tersinir olan bir pil reaksiyonunda her bir yarım pilin potansiyeli;
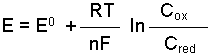
Nernst bağıntısı ile belirtilir. Örneğin,
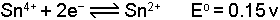
yarım pilinde elektrod potansiyeli
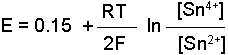
dır. [Sn2+] = [Sn4+] olduğunda (Cred=Cox; yükseltgen ve indirgen bileşenlerin molar konsantrasyonları eşit olursa) E=Eo olur. Bu durumda yarım pil potansiyeli standart elektrod potansiyeline eşit olmaktadır. İki yarım pilin meydana getirdiği pil sisteminde ise toplam potansiyel elektrod potansiyellerinin farkına eşittir. Örneğin A ve B gibi iki elektroddaki potansiyeller;
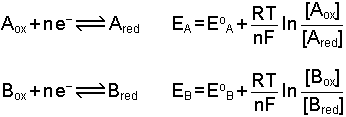
Bu sistemde EA>EB ise Aox Bred'i yükseltger. Bunun sonucu olarak [Aox] azalması ile birlikte EA da azalır. Buna karşılık EB artar ve [Bred] azalır. Böylece reaksiyon EA = EB oluncaya kadar devam eder. Bu halde dengeye ulaşılır.
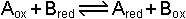
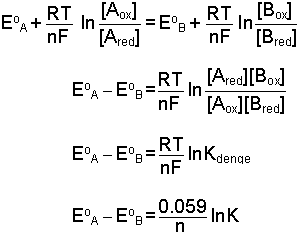
Kütlelerin etkimesi kanununa göre denge sabiti;

denge, ve elektrod potansiyelleri EA = EB olur.
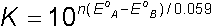

Tekrar doldurulabilinen piller.
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri























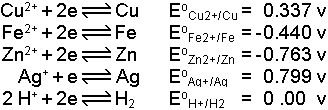
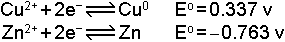
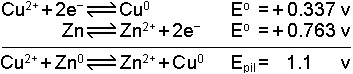

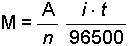
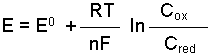
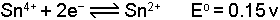
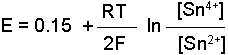
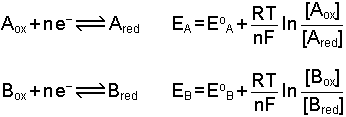
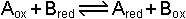


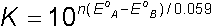
 Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri
Genel Kİmya konlarI
Genel Kİmya konlarI Devam
Genel Kİmya konlarI Geri



