Tel:
Fax:
Email:

www.hayatiboskut.com.tr





















Periyodik Cetvel
Elementlerin özelliklerine göre belirli bir sistematik düzende yerleştirilebilecekleri düşüncesi element kavramı ile başlamış olmakla birlikte, günümüzde kullanılan periyodik cetvelin oluşması için belirli aşamalar gerekmiştir.
Bu konu içinde;
- Günümüzde kullanılan periyodik cetvelin oluşumu için kaydedilen gelişmeler özetle verilecek ve
- Bu sistematiğin temel ilkeleri ile elementlerin genel özelliklerinden bahsedilecektir.
Bölüm Hedefi
Bu bölümü tamamladığınızda,
- Periyodik kanun ile anlatılmak istenen element özelliklerinin periyodik değişim sistematiğinin kavramış
- Elementlerin Atomik Özelliklerini tanımlayabilir
- Element ve bileşiklerinin genel kimyasal özelliklerinin periyodik değişimini incelemiş olacaksınız.
3.1 Periyodik Cetvel'in Tarihi
Bu bölüm altında şu alt başlıkları inceleyeceksiniz.
- İlk Periyodik Cetvel Tasarımları
- Modern Periyodik Cetvel
3.1.1 İlk Periyodik Cetvel Tasarımları
Elementlerin belirli bir kurala göre dizilmesi ile ilgili kayda değer ilk gelişme Alman kimyacı J. W. Döbereiner’e aittir. Döbereiner 1817 yılında; bazı elementlerin üçlü guruplar halinde ele alındığında atom tartıları arasında bir ilişkinin olduğunu fark etti. Örneğin, Kükürt, Selen ve Tellür üçlüsünde Selen’in atom tartısının diğer ikisinin atom tartılarının aritmetik ortalamasına eşit olduğunu buldu.
S-
3.1.2 Modern Periyodik Cetvel
Modern periyodik cetvel 1868-
Bir sonraki sırada benzer elementin olmadığı hallerde bunun yerini boş bırakarak böyle bir elementin mevcut olduğunu ve henüz keşfedilmediğini iddia etmiş, benzerliklerden yararlanarak henüz keşfedilmemiş 20’den fazla elementin özelliklerini gerçeğe çok yakın olarak tahmin edebilmiştir. Mendeleev adının Periyodik Cetvel ile birlikte anılmasına sebep olan başarısı bu tahminleridir. Örneğin Silisyum’un altında bulunması gereken Germenyumun henüz element olarak tanınmıyor olmasına rağmen, Mendeleev bu elementin mevcut olduğuna inanmış ve Eka-
Periyodik cetvelin atom numaralarına göre düzenlenmiş bugünkü hali Moseley’in X-

John Newlands'ın oluşturduğu tablo ve sıralama.
Moseley’in X-
3.2 Elementlerin Fiziksel (Atomik) Özellikleri
Periyodik Cetvelde yer alan elementlerin bağımsız atomik özellikleri fiziksel özellikler olarak nitelendirilir. Bir elementin fiziksel özelliklerinin yanı sıra kimyasal özelliklerini ve biyolojik sistemlerdeki davranışını da tayin eden bu temel büyüklükler;
- Atom Çapı,
- İyonizasyon Enerjisi ve Elektron İlgisidir.
3.2.1 Atom Yarıçapı
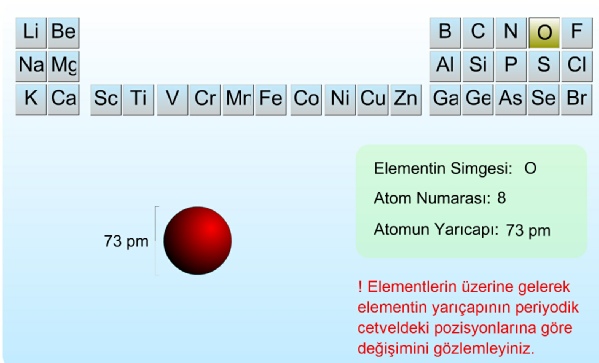
Elementlerin sahip olduğu özelliklerin şekillenmesinde hiç kuşkusuz en önemli pay atomun büyüklüğüdür. Genel anlamda atom büyüklüğünün (hacminin) bir ölçüsü olarak yarıçap kullanılır. Ancak fiziksel bakımdan bir atomun tam olarak büyüklüğünü belirlemek imkânsızdır. O halde izole edilmiş tek bir atomun büyüklüğünden söz etmek fizik bakımdan anlamsız olacaktır. Bu nedenle atom çapları çoğunlukla, birbirine bağlı atomların çekirdekleri arasındaki uzaklık dikkate alınarak hesaplanır. Öyleyse bir atomun yarıçapı birlikte bulunduğu diğer atomların sınırladığı kadardır ve bu yüzden bir elementin atom yarıçapı farklı bileşiklerde az da olsa farklılık gösterir.
Atom büyüklüklerinin ölçülmesinde kullanılan en etkili yöntem X-
Atom yarıçapı (ya da çapı) artan atom numarası ile periyodik değişimler gösterir. Atomda etkin çekirdek yükünün (Z*=Z-
Periyotlar cetvelinin yatay sıraları (periyotlar) boyunca sağa gidildikçe atom yarıçapı küçülür. Bunun nedeni baş kuantum sayısı (n) aynı kaldığı halde etkin çekirdek yükünün (Z*) artmasıdır. Çünkü yeni elektron aynı n sayılı orbitale ilave olmaktadır ve aynı n seviyesindeki elektronlar bu yeni elektrona etkin perdeleme yapamazlar. Örmekte; ikinci periyot elementleri için Slater kurallarına göre hesaplanan etkin çekirdek yükü (Z*) görülmektedir.
Periyotlar cetvelinin bir grubu içinde aşağıya doğru inildikçe, atom yarıçapı artar. Bu, baş kuantum sayısının artmasına karşılık etkin çekirdek yükünün büyük ölçüde artmayışındandır. Çünkü son elektron baş kuantum sayısı daha büyük olan yeni bir orbitale gelir ve dolayısıyla iç orbitallerdeki elektronlar, bu son elektrona etkin perdeleme uygulayarak çekirdeğe doğru çekilmesini azaltır. Dolayısı ile yarıçap aynı grupta aşağı inildikçe büyüme eğilimi gösterir.

Bölüm -